هيموفيليا /من ويكيبيديا، الموسوعة الحرة
الناعور{{نزف الدم الوراثي/النزاف}}الهيموفيليا

يعد نقص العامل الثامن أكثر الأسباب شيوعا.
النطق /hiːməˈfɪliə/
معلومات عامة
الاختصاص علم الدم
التاريخ
وصفها المصدر قاموس بروكهاوس وإفرون الموسوعي، وقاموس بروكهاوس وإفرون الموسوعي الصغير
، ومعجم التخاطب لماير
نزف الدم الوراثي أو الهيموفيليا أو الناعور أو النزاف
(بالإنجليزية: haemophilia) هو الاسم الذي يٌطلق على أي من الأمراض الوراثية المتعددة التي تسبب خللا في الجسم وتمنعه من السيطرة على عملية تخثر الدم. إن الأسباب الوراثية (أو نادرًا، أسباب في المناعة الذاتية للجسم) تسبب نقصا في عوامل تخثر البلازما الذي يعمل على تسوية عملية تخثر الدم، عندما يصاب وعاء دموي بجرح لن تتكون خثرة ويستمر الدم بالتدفق عوامل التخثر لمدة طويلة من الزمن. يمكن للنزيف أن يكون خارجيًا، كالجلد إذا تم حكه بشيء أو عندما يُصاب بقطع، أو أن يكون النزيف ظاهراً أي في الكدمات التي على الجلد، نزيفا داخلياً كنزيف الأمعاء أو النزيف الدماغي أو النزيف في العضلات أو المفاصل أو الأعضاء المجوفة.
ومثل الاضطرابات المتنحية الأخرى المرتبطة بالجنس، اضطرابات الصبغي (إكس)، يحدث الناعور في الذكور أكثر من الإناث. وذلك لأن الإناث يحملن اثنين من الصبغيات إكس بينما الذكور واحد فقط، لذلك فظهور المرض مضمون في أي من الذكور الذين يحملونه. فرصة وجود نسختين من الجينات المعيبة في الإناث بعيدة جدًا، لذلك الإناث غالبًا حاملات للمرض وينقلنه بدون أن تظهر عليهن أعراض. ترث الإناث الجينات المعيبة من الأم أو الأب أو قد تكون طفرة جديدة، على الرغم من ذلك؛ ليس مستحيلًا إصابة أنثى بمرض سيولة الدم.
التشخيص
التصنيفهناك عدة أنواع من الهيموفيليا: الهيموفيليا أ، والهيموفيليا ب، والهيموفيليا ج، والباراهيموفيليا، والهيموفيليا أ المكتسبة، والهيموفيليا ب المكتسبة.الهيموفيليا أ، هي اضطراب وراثي متنحٍّ مرتبط بالصبغي إكس يؤدي إلى نقص عامل التخثر الوظيفي الثامن. الهيموفيليا ب، هي أيضًا اضطراب وراثي متنحٍّ مرتبط بالصبغي إكس يتضمن نقص عامل التخثر الوظيفي التاسع. الهيموفيليا ج، هي اضطراب وراثي جسمي ينطوي على نقص عامل التخثر الوظيفي الحادي عشر. الهيموفيليا ج ليست اضطرابًا متنحيًا تمامًا، لأن الأفراد غير المتجانسين بالصفات الوراثية يُظهرون أيضًا نزيفًا متزايدًا.
نوع الهيموفيليا المعروف باسم باراهيموفيليا هو شكل خفيف ونادر سببه نقص في العامل الخامس. يمكن أن يكون هذا النوع موروثًا أو مكتسبًا.
يحدث الشكل غير الوراثي للهيموفيليا الناجم عن الأضداد الذاتية للعامل الثامن، ويُعرف أيضًا باسم الهيموفيليا أ المكتسبة. يمكن أن ترتبط الهيموفيليا المكتسبة بالسرطانات، واضطرابات المناعة الذاتية، وما بعد الولادة.
المعالجةلا يوجد علاج طويل الأمد. إن معالجة نوبات النزف والوقاية منها تجريان بشكل أساسي بواسطة تعويض عوامل تخثر الدم المفقودة.
عوامل التخثر ليس هناك حاجة لعوامل التخثر في حالات الهيموفيليا الخفيفة عادةً. في حالات الهيموفيليا متوسطة الشدة، ليس هناك حاجة لعوامل التخثر عادةً إلا عند حدوث النزيف أو من أجل الوقاية منه في ظروف معينة. في حالات الهيموفيليا الشديدة، يوصى بالرعاية الوقائية مرتين أو ثلاث مرات في الأسبوع، ويمكن أن تستمر مدى الحياة. يؤدي العلاج السريع لحوادث النزيف إلى تقليل الضرر الذي يلحق بالجسم.
يُستخدم العامل الثامن في الهيموفيليا أ والعامل التاسع في الهيموفيليا ب. يمكن التعويض إما بواسطة العامل المعزول من مصل الدم البشري، أو العامل المعاد تركيبه (المأشوب)، أو بواسطة مزيج من الاثنين. يطور بعض الأشخاص أجسامًا مضادة (مثبطات) ضد العوامل التعويضية المعطاة لهم، لذلك يجب زيادة مقدار العامل أو إعطاء منتجات بديلة غير بشرية، مثل العامل الثامن المأخوذ من الخنزير.
إذا أصبح الشخص مقاومًا للعلاج عبر تعويض عامل التخثر نتيجةً لمستويات عالية من المثبطات الجائلة في الدوران، فيمكن التغلّب على هذا الأمر جزئيًا باستخدام العامل البشري الثامن المُعاد تركيبه.
في أوائل عام 2008، وافقت إدارة الغذاء والدواء الأمريكية (إف دي إيه) على عامل مضاد للهيموفيليا رُكّب وراثيًا من جينات خلايا بويضة الهامستر الصيني. منذ عام 1993، كانت منتجات العوامل المعاد تركيبها (التي تُصَنّع عادةً من خلايا الأنسجة المُستنبتة لبويضة الهامستر الصيني، والتي تتضمن القليل من منتجات بلازما الدم البشرية) متاحة ومستخدمة على نطاق واسع في الدول الغربية الأكثر ثراءً. في حين أن منتجات عامل التخثر المعاد تركيبه توفر درجة أعلى من النقاء والسلامة، فإنها، باعتبارها مركّزة، مكلفةٌ للغاية، وغير متاحة عمومًا في العالم النامي. في كثير من الحالات، يصعب الحصول على منتجات العوامل من أي نوع في البلدان النامية.
تُعطى عوامل التخثر إما بشكل وقائي أو عند الحاجة. يتضمن الاستخدام الوقائي ضخ عامل التخثر وفقًا لجدول زمني منتظم للحفاظ على مستويات التخثر مرتفعة بما يكفي لمنع نوبات النزيف التلقائي. يتضمن العلاج عند الحاجة (أو العرضي) علاج نوبات النزف بمجرد ظهورها. في عام 2007، قارنت تجربة بين العلاج عند الحاجة للأولاد (أقل من 30 شهرًا) المصابين بالهيموفيليا أ مع العلاج الوقائي (إعطاء 25 وحدة دولية لكل كيلوغرام من وزن الجسم من العامل الثامن كل يوم) من ناحية التأثير على منع حدوث المرض المفصلي. عندما بلغ الأولاد 6 سنوات، كان 93% من أفراد مجموعة الوقاية و55% من أفراد مجموعة العلاج العَرَضي لديهم بنية مفصلية طبيعية عند التصوير بالرنين المغناطيسي. ومع ذلك، نتج عن العلاج الوقائي متوسط تكاليف قدرها 300,000 دولار في السنة. يؤيد صاحب المقال الافتتاحي الذي نُشر في نفس العدد من مجلة نيو إنغلاند جورنال أوف ميديسين فكرة أن العلاج الوقائي ليس أكثر فعالية من العلاج عند الحاجة فقط، بل يشير أيضًا إلى أن البدء بعد أول نزيف خطير مرتبط بالمفاصل يمكن أن يكون أكثر فعالية من ناحية التكلفة من الانتظار حتى بلوغ السن الثابتة للبدء. لدى معظم مرضى الهيموفيليا في بلدان العالم الثالث وصول محدود أو معدوم إلى منتجات عوامل تخثر الدم التجارية.
العلامات والأعراض والأعراض المميزة تختلف مع شدة المرض. بشكل عام الأعراض عبارة عن نوبات من النزيف الداخلي أو الخارجي. تتراوح شدة النزف بين المعتدل أو الخطير ولكن حتى في الهيموفيليا المعتدلة تزداد الأعراض بعد الجراحة أو الصدمات الخطيرة. في كل من الناعور أ وب، هناك نزيف تلقائي ولكن زمن فترة النزيف طبيعي، وقت البروثرومبين طبيعي، وقت الثرومبين طبيعي، ولكن يطول وقت تجلط الدم الجزئي. النزيف الداخلي شائع في الناس مع الهيموفيليا الشديدة وبعض الأفراد الذين يعانون من الهيموفيليا المعتدلة. النوع الأكثر تميزًا للنزف الداخلي هو نزف المفاصل وحتى يمكن أن يحدث من تلقاء نفسه (من دون صدمة واضحة). إذا لم يعالج بسرعة، يمكن أن يؤدي النزيف إلى تلف المفاصل الدائم والتشوه.
النزيف في الأنسجة الرخوة مثل العضلات والأنسجة تحت الجلد أقل حدة ولكن يمكن أن يؤدي إلى تلف لذا يتطلب العلاج.
الأطفال الذين يعانون من الناعور المعتدل قد لا تظهر أي علامات أو أعراض لديهم عند الولادة خاصةً إذا لم تحدث لهم عملية الختان. ظهور أول الأعراض غالبًا ما تكون كدمات وتورمات من السقطات المتكررة أثناء تعلمهم المشي. قد يحدث أيضًا تورم وكدمات من نزيف في المفاصل والأنسجة الرخوة أو العضلات. أو قد تكون أول العلامات هي نزيف حاد من عمليات الأسنان، وقوع حادث، أو الجراحة. الإناث الحاملات للمرض عادة ما يكون لديهن ما يكفي من عوامل التخثُّر لمنع حدوث مشاكل النزيف الخطيرة، ولكن البعض قد يتعرضن للهيموفيليا الخفيفة.
المضاعفاتالمضاعفات الخطيرة أكثر شيوعًا في المصابين بنزف الدم الحاد والمعتدل. قد تكون المضاعفات سواء بصورة مباشرة من المرض أو أثناء العلاج:نزيف داخلي عميق، على سبيل المثال، نزيف العضلات العميقة، مما يؤدي إلى تورم، وخدر أو آلام الأطراف.
تلف المفاصل من تدمي المفصل مع الألم الشديد والتشوه، نتيجة لالتهاب المفصل وتدميره.
الإصابة بالعدوى التي تنتقل من عمليات نقل الدم أثناء العلاج.
ردود الفعل السلبية أثناء المعالجة بعوامل التخثُّر، بما في ذلك تطوير مثبطات المناعة مما يجعل استبدال العوامل أقل فعالية.
نزيف بالمخ وهي حالة طبية طارئة ناجمة عن تراكم الضغط داخل الجمجمة. ويمكن أن يسبب الغثيان وفقدان الوعي، تلف المخ، والموت.
يأتي تدمّي المفاصل بسبب الناعور في شكل التهاب الأغشية المفصلية المزمن وتدمير الغضاريف، إذا لم يُسحب الدم من داخل المفصل بسرعة يمكن أن يؤدي إلى موت الخلايا الغضروفية ويؤثر على تركيب البروتيوغليكان. قد تكون بطانة المفاصل المتضخمة والهشة عرضة للنزف مجددًا أثناء محاولة التخلص من الدم المتزايد، مما يؤدي إلى حلقة مفرغة من تدمي المفصل. وبالإضافة إلى ذلك، ترسب الحديد في الغشاء الزليلي قد يحفز استجابة التهابية وتنشيط نظام المناعة، وتحفيز الأوعية الدموية، مما يؤدي لتدمير الغضاريف والعظام.
متوسط العمر المُتوقَّعمثل معظم جوانب المرض، يتفاوت العمر المتوقع باختلاف شدة المرض وتوافر العلاج المناسب. الأشخاص الذين يعانون من الهيموفيليا الشديدة أو لا يحصلون على علاج مناسب يقل متوسط أعمارهم المتوقعة بشكل كبير، غالبًا لايصلون إلى مرحلة النضج. قبل الستينات عندما أصبح العلاج الفعّال متاحًا، كان متوسط العمر المتوقع 11 عام. وفي الثمانينات كان العمر المتوقع لمرضى الناعور 50-60 سنة. أمااليوم مع توافر العلاج المناسب، فإن الذكور المصابين بالناعور لديهم متوسط أعمار طبيعي، أو ما يقرب من 10 أعوام أقصر من الذكور الأصحاء.منذ الثمانينات، تحول السبب الرئيسي لوفاة الأشخاص الذين يعانون من الناعور الشديد من النزيف إلى الإصابة بمرض نقص المناعة المكتسبة (الإيدز) أثناء العلاج أو استخدام منتجات الدم الملوثة. ثاني الأسباب الرئيسية للوفاة متعلق بالمضاعفات الخطيرة وهي نزيف المخ، الذي يمثل اليوم ثلث مجموع الوفيات من الناس المصابين بالناعور. تشمل اثنين من الأسباب الرئيسية الأخرى للوفاة التهابات الكبد مسببة التليف وانسداد مجرى الهواء أو تدفق الدم بسبب نزيف الأنسجة الرخوة.
أنواع مرض نزف الدم
هيموفيليا أ– قلة العامل الثامن وتمثل 80% من حالات سيولة الدم.
هيموفيليا ب– قلة العامل التاسع وتمثل تقريبًا 20% من الحالات.هيموفيليا ج – قلة العامل الحادي عشر وهي اضطراب وراثي أي لا يرتبط بالصبغي إكس.
وتعتبر الهيموفيليا (أ) و (ب) الأكثر انتشاراً في الوطن العربي نتيجة لنقص بروتينات التجلط (8) و (9) على التوالي وتظهر الهيموفيليا (أ) و (ب) بين الذكور دون الإناث ويكون انتقال العامل الوراثي من الأم إلى الابن الذكر وليس من الأب إلى الأبن، حيث أن الابنة هي التي تكون حاملة للمرض وتورثه لأبنائها الذكور دون أن تظهر عليها الأعراض.
جينات
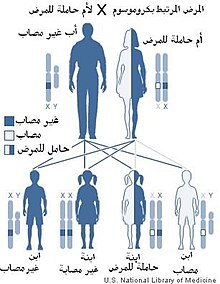
انتقال جين الهيموفيليا بين أفراد العائلة
تمتلك الإناث صبغيين X بينما لدى الذكور صبغي Y وآخر X. وبما أن الطفرة المسببة مرتبطة بالصبغي X، تحمل الأنثى المرض على أحد الصبغيين X ولا تكون مٌتأثرة به لأن الصبغي الآخر الذي هو X أيضاً سيعمل على توليد عوامل التخثر. أما الذكر فإن الصبغي Y لديه لا يحمل أي جينات لتكوين عاملي التخثُّر الثامن أو التاسع، لذا فإنه إذا كانت الجينات على الصبغي X بها عيب فإنها ستؤدي إلى ظهور المرض. بما أن الذكر يرث الصبغي X من أمه فإن نسبة إصابة ابن لأم حاملة للمرض هي 50%, أما إذا كانت الأم مصابة فإن نسبة إصابة الابن تصبح 100%. على العكس، الابنة سترث إحدى الصبغيين من الأم والآخر من الأب لذلك فرصة إصابة الذكور بالمرض أكثر من الإناث. حديثًا؛ زادت نسبة إصابة الإناث بالمرض حيث مكّنت طرق العلاج الحديثة والمن متوافرة الذكور من البقاء على قيد الحياة والوصل إلى سن الرشد ليصبحوا آباء وبالتالي زيادة فرص إصابة بناتهم. من الأعراض التي قد تظهر على الإناث غزارة الطمث.
يEوصى بالاختبارات الجينية والاستشارة الوراثية للعائلات المصابة بالناعور. اختبارات ما قبل الولادة، مثل بزل السلى.
وكما هو الحال مع جميع الأمراض الوراثية؛ من الممكن للبشر الإصابة بالمرض من خلال الطفرة، بدلا من وراثته، وذلك بسبب طفرات جديدة في واحدة من أمشاج الأبوين. وتمثل الطفرات التلقائية حوالي 33٪ من جميع حالات الناعور أ، وحوالي 30٪ من حالات الناعور ب. كان من المستحيل تحديد ما إذا كانت الأم هي الحاملة للمرض أم السبب طفرة حتى ظهور اختبار الحمض النووي المباشر الحديث.
شدة المرضهناك العديد من الطفرات المختلفة التي تسبب كل نوع من الهيموفيليا أ، ب أو ج. بسبب الاختلافات في التغييرات الجينية، مرضى الهيموفيليا لديهم مستوى معيّن من عامل التخثّر. عندما يكون عامل التخثر أقل من 1 % تصنّف الحالة بالهيموفيليا الشديدة. في حال كان من 1-5% تصنّف هذه الحالة بالهيموفيليا المتوسطة أما عندما يكون عامل التخثر طبيعي بين 5-40% تصنّف الحالة بالهيموفيليا المعتدلة.
التشخيصيمكن للناعور أن يشابه مرض فون ويلبراند.
حيث أن انخفاض مستويات عامل فون ويلبراند يمكن أن يؤدي إلى التحلل البروتيني للعامل الثامن. بالإضافة إلى أن الحالات الشديدة من نقص فيتامين K قد تُظهر أعراضًا مشابهة لمرض سيولة الدم. وذلك لأن فيتامين K ضروري لجسم الإنسان لإنتاج عدة عوامل تخثُّر. نقص الفيتامين أمر نادر الحدوث في البالغين والأطفال الأكبر سنًا لكنَّه شائع في حديثي الولادة. يولد الأطفال الرضع لديهم مستويات منخفضة بشكل طبيعي من فيتامين K وليس لديهم حتى الآن بكتيريا الأمعاء التي تقوم بتخليق فيتامين k, يعرف هذا باسم «مرض نزف حديثي الولادة». ولتجنب هذه المضاعفات، يتم حقن حديثي الولادة بصورة روتينية بمكملات فيتامين K.
العلاج

العامل الثامن
لوقف النزيف يُنصح باستخدام الثلج الموضعي عند حدوث أي نزيف خاصة بالمفاصل مع أخذ مسكنات للآلام. على الرغم من أنه لا يوجد علاج لمرض سيولة الدم، إلا أنه يمكن السيطرة عليه بالحقن العادية لعامل التخثر الناقص، أي العامل الثامن في الناعور أ أو العامل التاسع في الناعور ب. يتم إعطاء الطفل بروتين التجلط المناسب عن طريق الوريد كل 12 ساعة لمدة يومين أو ثلاثة أيام ليساعد الدم علي التجلط وهناك العديد من مشتقات البلازما التي يمكن استخدامها في هذه الحالات وإن كانت بروتينات التجلط التي يتم تصنيعها باستخدام الهندسة الوراثية تعتبر أفضل من البلازما التي قد ينتج عنها انتقال بعض الأمراض مثل التهاب الكبد سي. يكوّن بعض مرضى الهيموفيليا أجسام مضادة (مثبطات) ضد العوامل المُستبدلة المعطاة لهم، وبالتالي فلابد من زيادة كمية العامل لابد من زيادة أو تُعطى المنتجات البديلة غير البشرية، مثل العامل الثامن المُصنَّع من الخنازير. في أوائل عام 2008، وافقت إدارة الغذاء والدواء الأمريكية على (وايث) عامل مضاد للهيموفيليا مُصنَّع بالهندسة الوراثية من جينات من خلايا مبيض الهامستر الصيني. منذ عام 1993 استخدمت على نطاق واسع في الدول الغربية الغنية منتجات عامل التخثر الغير بشرية التي توفر أعلى نقاء وسلامة، لكنَّها مكلفة للغاية فلم تتوافر في العالم النامي. ومن الصعب الحصول على منتجات العوامل من أي نوع في البلدان النامية. وهناك العلاج الوقائي عن طريق حقن الطفل المريض كل 48 ساعة بمعاملات التجلط ورغم أنه يتكلف أكثر من العلاج بالبلازما لكنه يفيد في الحفاظ على المفاصل والعضلات في حالتها الطبيعية حتى لا تحدث أي إعاقة للطفل.
العلاج الجينيو أفضل ما يعالج به مريض الهيموفيليا هو العلاج بالجينات مرة واحدة فتكفيه لمدة عام، ويمكن تفادي الانتقال الوراثي للمرض عن طريق إجراء تحاليل قبل الزواج أو الحمل إذا كان الزوج مريضاً أو في حالة وجود طفل مصاب في أسرة الإناث المقبلات على الزواج؛ عليهم قياس نسبة الخلل في الجينات وسرعة التجلط وقياس بروتينات التجلط (8) و (9), في حالة حدوث حمل يتم تحديد نوع الجنين فإذا كان أنثى يستمر الحمل أما إذا كان ذكرًا فيتم عمل تحاليل للدم في الخلايا الموجودة في السائل الأمينوسي وتحليل الجينات حتى نتجنب إعاقة الأطفال.</ref>
تمارين وقائيةمن المستحسن أن يقوم الأشخاص المصابين بالهيموفيليا بتمارين محددة لتعزيز المفاصل خاصةً المرفقين، الركبتين والكاحلين. يُوصى بهذه التدريبات يوميًا لتقوية العضلات وبعد النزيف الداخلي خصوصًا لمنع مشاكل النزيف من جديد. من التدريبات: الإحماء، دوائر الكاحل، انحناء الكوع وتمديد عضلات الفخذ.
المحظوراتيُمنع استخدام مضادات التخثر مثل الهيبارين والوارفارين للأشخاص الذين يعانون من الناعور حيث أنها يمكن أن تؤدي إلى تفاقم الحالة. ويُمنع أيضًا الأدوية التي تسبب «سيولة الدم» كآثار جانبية. على سبيل المثال، الأسبرين والايبوبروفين، أو الصوديوم نابروكسين حيث تؤدي إلى إطالة زمن النزيف.كما يجب تجنب الأنشطة التي يُحتمل التعرض فيها للإصابة، مثل الدراجات النارية والتزلج. الرياضات ذات المعدلات العالية من الاتصال الجسدي والإصابات مثل كرة القدم الأميركية والهوكي والملاكمة والمصارعة، كرة القدم والبيسبول وكرة السلة.
علم الأوبئةالناعور مرض نادر، فقط حوالي 1 في كل 10000 ولادة (أو 1 في كل 5000 من الذكور) الناعور أ 1 في كل 50000 ولادة، الناعور ب 1 من كل 18000 شخص في الولايات المتحدة. كل سنة في الولايات المتحدة، يولد حوالي 400 طفل مصاب بهذا المرض.
اكتشاف علمي كان أبوالقاسم الزهراوي أول متخصص طبي يصف المرض. في القرن العاشر وصف الأسر التي توفى ذكورها من نزيف بعد صدمات طفيفة. لكن لم يبدأ التحليل العلمي حتى بداية القرن التاسع عشر. عام 1803، كتب طبيب من فيلادلفيا يدعى جون كنارد أوتو مقالة عن «ميل للنزيف يوجد في عائلات معينة». وقد أدرك أن الحالة كانت وراثية وتؤثر على الذكور فقط انتقالًا عبر إناث صحيحات. وكانت ورقته هي الورقة الثانية لوصف خصائص مهمة لاضطراب وراثي مرتبط بالصبغي X (الورقة الأولى كانت في وصف عمى الألوان من قبل جون دالتون الذي درس عائلته). وُصف المرض عام 1813 من قبل جون هاي، حيث نشر مقالة في الصحيفة الطبية بنيو انغلاند.في عام 1924، اكتشف طبيب فنلندي اضطراب نزيف وراثي مماثل لمرض الهيموفيليا في «جزر آلاند»، جنوب غرب فنلندا، ويسمى هذا الاضطراب «مرض فون فيلبراند». وقد ظهرت كلمة «هيموفيليا» أول مرة في وصف هذا المرض سنة 1828م حيث كتبها عالم يدعى هوبف في جامعة زيورخ.
وفي عام 1947 وجد طبيب من بوينس آيرس، أن الناعور نوعين أ وب وهما مرضان منفصلان.
العائلة المالكة الأوروبية
الناعور{{نزف الدم الوراثي/النزاف}}الهيموفيليا

يعد نقص العامل الثامن أكثر الأسباب شيوعا.
النطق /hiːməˈfɪliə/
معلومات عامة
الاختصاص علم الدم
التاريخ
وصفها المصدر قاموس بروكهاوس وإفرون الموسوعي، وقاموس بروكهاوس وإفرون الموسوعي الصغير
، ومعجم التخاطب لماير
نزف الدم الوراثي أو الهيموفيليا أو الناعور أو النزاف
(بالإنجليزية: haemophilia) هو الاسم الذي يٌطلق على أي من الأمراض الوراثية المتعددة التي تسبب خللا في الجسم وتمنعه من السيطرة على عملية تخثر الدم. إن الأسباب الوراثية (أو نادرًا، أسباب في المناعة الذاتية للجسم) تسبب نقصا في عوامل تخثر البلازما الذي يعمل على تسوية عملية تخثر الدم، عندما يصاب وعاء دموي بجرح لن تتكون خثرة ويستمر الدم بالتدفق عوامل التخثر لمدة طويلة من الزمن. يمكن للنزيف أن يكون خارجيًا، كالجلد إذا تم حكه بشيء أو عندما يُصاب بقطع، أو أن يكون النزيف ظاهراً أي في الكدمات التي على الجلد، نزيفا داخلياً كنزيف الأمعاء أو النزيف الدماغي أو النزيف في العضلات أو المفاصل أو الأعضاء المجوفة.
ومثل الاضطرابات المتنحية الأخرى المرتبطة بالجنس، اضطرابات الصبغي (إكس)، يحدث الناعور في الذكور أكثر من الإناث. وذلك لأن الإناث يحملن اثنين من الصبغيات إكس بينما الذكور واحد فقط، لذلك فظهور المرض مضمون في أي من الذكور الذين يحملونه. فرصة وجود نسختين من الجينات المعيبة في الإناث بعيدة جدًا، لذلك الإناث غالبًا حاملات للمرض وينقلنه بدون أن تظهر عليهن أعراض. ترث الإناث الجينات المعيبة من الأم أو الأب أو قد تكون طفرة جديدة، على الرغم من ذلك؛ ليس مستحيلًا إصابة أنثى بمرض سيولة الدم.
التشخيص
التصنيفهناك عدة أنواع من الهيموفيليا: الهيموفيليا أ، والهيموفيليا ب، والهيموفيليا ج، والباراهيموفيليا، والهيموفيليا أ المكتسبة، والهيموفيليا ب المكتسبة.الهيموفيليا أ، هي اضطراب وراثي متنحٍّ مرتبط بالصبغي إكس يؤدي إلى نقص عامل التخثر الوظيفي الثامن. الهيموفيليا ب، هي أيضًا اضطراب وراثي متنحٍّ مرتبط بالصبغي إكس يتضمن نقص عامل التخثر الوظيفي التاسع. الهيموفيليا ج، هي اضطراب وراثي جسمي ينطوي على نقص عامل التخثر الوظيفي الحادي عشر. الهيموفيليا ج ليست اضطرابًا متنحيًا تمامًا، لأن الأفراد غير المتجانسين بالصفات الوراثية يُظهرون أيضًا نزيفًا متزايدًا.
نوع الهيموفيليا المعروف باسم باراهيموفيليا هو شكل خفيف ونادر سببه نقص في العامل الخامس. يمكن أن يكون هذا النوع موروثًا أو مكتسبًا.
يحدث الشكل غير الوراثي للهيموفيليا الناجم عن الأضداد الذاتية للعامل الثامن، ويُعرف أيضًا باسم الهيموفيليا أ المكتسبة. يمكن أن ترتبط الهيموفيليا المكتسبة بالسرطانات، واضطرابات المناعة الذاتية، وما بعد الولادة.
المعالجةلا يوجد علاج طويل الأمد. إن معالجة نوبات النزف والوقاية منها تجريان بشكل أساسي بواسطة تعويض عوامل تخثر الدم المفقودة.
عوامل التخثر ليس هناك حاجة لعوامل التخثر في حالات الهيموفيليا الخفيفة عادةً. في حالات الهيموفيليا متوسطة الشدة، ليس هناك حاجة لعوامل التخثر عادةً إلا عند حدوث النزيف أو من أجل الوقاية منه في ظروف معينة. في حالات الهيموفيليا الشديدة، يوصى بالرعاية الوقائية مرتين أو ثلاث مرات في الأسبوع، ويمكن أن تستمر مدى الحياة. يؤدي العلاج السريع لحوادث النزيف إلى تقليل الضرر الذي يلحق بالجسم.
يُستخدم العامل الثامن في الهيموفيليا أ والعامل التاسع في الهيموفيليا ب. يمكن التعويض إما بواسطة العامل المعزول من مصل الدم البشري، أو العامل المعاد تركيبه (المأشوب)، أو بواسطة مزيج من الاثنين. يطور بعض الأشخاص أجسامًا مضادة (مثبطات) ضد العوامل التعويضية المعطاة لهم، لذلك يجب زيادة مقدار العامل أو إعطاء منتجات بديلة غير بشرية، مثل العامل الثامن المأخوذ من الخنزير.
إذا أصبح الشخص مقاومًا للعلاج عبر تعويض عامل التخثر نتيجةً لمستويات عالية من المثبطات الجائلة في الدوران، فيمكن التغلّب على هذا الأمر جزئيًا باستخدام العامل البشري الثامن المُعاد تركيبه.
في أوائل عام 2008، وافقت إدارة الغذاء والدواء الأمريكية (إف دي إيه) على عامل مضاد للهيموفيليا رُكّب وراثيًا من جينات خلايا بويضة الهامستر الصيني. منذ عام 1993، كانت منتجات العوامل المعاد تركيبها (التي تُصَنّع عادةً من خلايا الأنسجة المُستنبتة لبويضة الهامستر الصيني، والتي تتضمن القليل من منتجات بلازما الدم البشرية) متاحة ومستخدمة على نطاق واسع في الدول الغربية الأكثر ثراءً. في حين أن منتجات عامل التخثر المعاد تركيبه توفر درجة أعلى من النقاء والسلامة، فإنها، باعتبارها مركّزة، مكلفةٌ للغاية، وغير متاحة عمومًا في العالم النامي. في كثير من الحالات، يصعب الحصول على منتجات العوامل من أي نوع في البلدان النامية.
تُعطى عوامل التخثر إما بشكل وقائي أو عند الحاجة. يتضمن الاستخدام الوقائي ضخ عامل التخثر وفقًا لجدول زمني منتظم للحفاظ على مستويات التخثر مرتفعة بما يكفي لمنع نوبات النزيف التلقائي. يتضمن العلاج عند الحاجة (أو العرضي) علاج نوبات النزف بمجرد ظهورها. في عام 2007، قارنت تجربة بين العلاج عند الحاجة للأولاد (أقل من 30 شهرًا) المصابين بالهيموفيليا أ مع العلاج الوقائي (إعطاء 25 وحدة دولية لكل كيلوغرام من وزن الجسم من العامل الثامن كل يوم) من ناحية التأثير على منع حدوث المرض المفصلي. عندما بلغ الأولاد 6 سنوات، كان 93% من أفراد مجموعة الوقاية و55% من أفراد مجموعة العلاج العَرَضي لديهم بنية مفصلية طبيعية عند التصوير بالرنين المغناطيسي. ومع ذلك، نتج عن العلاج الوقائي متوسط تكاليف قدرها 300,000 دولار في السنة. يؤيد صاحب المقال الافتتاحي الذي نُشر في نفس العدد من مجلة نيو إنغلاند جورنال أوف ميديسين فكرة أن العلاج الوقائي ليس أكثر فعالية من العلاج عند الحاجة فقط، بل يشير أيضًا إلى أن البدء بعد أول نزيف خطير مرتبط بالمفاصل يمكن أن يكون أكثر فعالية من ناحية التكلفة من الانتظار حتى بلوغ السن الثابتة للبدء. لدى معظم مرضى الهيموفيليا في بلدان العالم الثالث وصول محدود أو معدوم إلى منتجات عوامل تخثر الدم التجارية.
العلامات والأعراض والأعراض المميزة تختلف مع شدة المرض. بشكل عام الأعراض عبارة عن نوبات من النزيف الداخلي أو الخارجي. تتراوح شدة النزف بين المعتدل أو الخطير ولكن حتى في الهيموفيليا المعتدلة تزداد الأعراض بعد الجراحة أو الصدمات الخطيرة. في كل من الناعور أ وب، هناك نزيف تلقائي ولكن زمن فترة النزيف طبيعي، وقت البروثرومبين طبيعي، وقت الثرومبين طبيعي، ولكن يطول وقت تجلط الدم الجزئي. النزيف الداخلي شائع في الناس مع الهيموفيليا الشديدة وبعض الأفراد الذين يعانون من الهيموفيليا المعتدلة. النوع الأكثر تميزًا للنزف الداخلي هو نزف المفاصل وحتى يمكن أن يحدث من تلقاء نفسه (من دون صدمة واضحة). إذا لم يعالج بسرعة، يمكن أن يؤدي النزيف إلى تلف المفاصل الدائم والتشوه.
النزيف في الأنسجة الرخوة مثل العضلات والأنسجة تحت الجلد أقل حدة ولكن يمكن أن يؤدي إلى تلف لذا يتطلب العلاج.
الأطفال الذين يعانون من الناعور المعتدل قد لا تظهر أي علامات أو أعراض لديهم عند الولادة خاصةً إذا لم تحدث لهم عملية الختان. ظهور أول الأعراض غالبًا ما تكون كدمات وتورمات من السقطات المتكررة أثناء تعلمهم المشي. قد يحدث أيضًا تورم وكدمات من نزيف في المفاصل والأنسجة الرخوة أو العضلات. أو قد تكون أول العلامات هي نزيف حاد من عمليات الأسنان، وقوع حادث، أو الجراحة. الإناث الحاملات للمرض عادة ما يكون لديهن ما يكفي من عوامل التخثُّر لمنع حدوث مشاكل النزيف الخطيرة، ولكن البعض قد يتعرضن للهيموفيليا الخفيفة.
المضاعفاتالمضاعفات الخطيرة أكثر شيوعًا في المصابين بنزف الدم الحاد والمعتدل. قد تكون المضاعفات سواء بصورة مباشرة من المرض أو أثناء العلاج:نزيف داخلي عميق، على سبيل المثال، نزيف العضلات العميقة، مما يؤدي إلى تورم، وخدر أو آلام الأطراف.
تلف المفاصل من تدمي المفصل مع الألم الشديد والتشوه، نتيجة لالتهاب المفصل وتدميره.
الإصابة بالعدوى التي تنتقل من عمليات نقل الدم أثناء العلاج.
ردود الفعل السلبية أثناء المعالجة بعوامل التخثُّر، بما في ذلك تطوير مثبطات المناعة مما يجعل استبدال العوامل أقل فعالية.
نزيف بالمخ وهي حالة طبية طارئة ناجمة عن تراكم الضغط داخل الجمجمة. ويمكن أن يسبب الغثيان وفقدان الوعي، تلف المخ، والموت.
يأتي تدمّي المفاصل بسبب الناعور في شكل التهاب الأغشية المفصلية المزمن وتدمير الغضاريف، إذا لم يُسحب الدم من داخل المفصل بسرعة يمكن أن يؤدي إلى موت الخلايا الغضروفية ويؤثر على تركيب البروتيوغليكان. قد تكون بطانة المفاصل المتضخمة والهشة عرضة للنزف مجددًا أثناء محاولة التخلص من الدم المتزايد، مما يؤدي إلى حلقة مفرغة من تدمي المفصل. وبالإضافة إلى ذلك، ترسب الحديد في الغشاء الزليلي قد يحفز استجابة التهابية وتنشيط نظام المناعة، وتحفيز الأوعية الدموية، مما يؤدي لتدمير الغضاريف والعظام.
متوسط العمر المُتوقَّعمثل معظم جوانب المرض، يتفاوت العمر المتوقع باختلاف شدة المرض وتوافر العلاج المناسب. الأشخاص الذين يعانون من الهيموفيليا الشديدة أو لا يحصلون على علاج مناسب يقل متوسط أعمارهم المتوقعة بشكل كبير، غالبًا لايصلون إلى مرحلة النضج. قبل الستينات عندما أصبح العلاج الفعّال متاحًا، كان متوسط العمر المتوقع 11 عام. وفي الثمانينات كان العمر المتوقع لمرضى الناعور 50-60 سنة. أمااليوم مع توافر العلاج المناسب، فإن الذكور المصابين بالناعور لديهم متوسط أعمار طبيعي، أو ما يقرب من 10 أعوام أقصر من الذكور الأصحاء.منذ الثمانينات، تحول السبب الرئيسي لوفاة الأشخاص الذين يعانون من الناعور الشديد من النزيف إلى الإصابة بمرض نقص المناعة المكتسبة (الإيدز) أثناء العلاج أو استخدام منتجات الدم الملوثة. ثاني الأسباب الرئيسية للوفاة متعلق بالمضاعفات الخطيرة وهي نزيف المخ، الذي يمثل اليوم ثلث مجموع الوفيات من الناس المصابين بالناعور. تشمل اثنين من الأسباب الرئيسية الأخرى للوفاة التهابات الكبد مسببة التليف وانسداد مجرى الهواء أو تدفق الدم بسبب نزيف الأنسجة الرخوة.
أنواع مرض نزف الدم
هيموفيليا أ– قلة العامل الثامن وتمثل 80% من حالات سيولة الدم.
هيموفيليا ب– قلة العامل التاسع وتمثل تقريبًا 20% من الحالات.هيموفيليا ج – قلة العامل الحادي عشر وهي اضطراب وراثي أي لا يرتبط بالصبغي إكس.
وتعتبر الهيموفيليا (أ) و (ب) الأكثر انتشاراً في الوطن العربي نتيجة لنقص بروتينات التجلط (8) و (9) على التوالي وتظهر الهيموفيليا (أ) و (ب) بين الذكور دون الإناث ويكون انتقال العامل الوراثي من الأم إلى الابن الذكر وليس من الأب إلى الأبن، حيث أن الابنة هي التي تكون حاملة للمرض وتورثه لأبنائها الذكور دون أن تظهر عليها الأعراض.
جينات

انتقال جين الهيموفيليا بين أفراد العائلة
تمتلك الإناث صبغيين X بينما لدى الذكور صبغي Y وآخر X. وبما أن الطفرة المسببة مرتبطة بالصبغي X، تحمل الأنثى المرض على أحد الصبغيين X ولا تكون مٌتأثرة به لأن الصبغي الآخر الذي هو X أيضاً سيعمل على توليد عوامل التخثر. أما الذكر فإن الصبغي Y لديه لا يحمل أي جينات لتكوين عاملي التخثُّر الثامن أو التاسع، لذا فإنه إذا كانت الجينات على الصبغي X بها عيب فإنها ستؤدي إلى ظهور المرض. بما أن الذكر يرث الصبغي X من أمه فإن نسبة إصابة ابن لأم حاملة للمرض هي 50%, أما إذا كانت الأم مصابة فإن نسبة إصابة الابن تصبح 100%. على العكس، الابنة سترث إحدى الصبغيين من الأم والآخر من الأب لذلك فرصة إصابة الذكور بالمرض أكثر من الإناث. حديثًا؛ زادت نسبة إصابة الإناث بالمرض حيث مكّنت طرق العلاج الحديثة والمن متوافرة الذكور من البقاء على قيد الحياة والوصل إلى سن الرشد ليصبحوا آباء وبالتالي زيادة فرص إصابة بناتهم. من الأعراض التي قد تظهر على الإناث غزارة الطمث.
يEوصى بالاختبارات الجينية والاستشارة الوراثية للعائلات المصابة بالناعور. اختبارات ما قبل الولادة، مثل بزل السلى.
وكما هو الحال مع جميع الأمراض الوراثية؛ من الممكن للبشر الإصابة بالمرض من خلال الطفرة، بدلا من وراثته، وذلك بسبب طفرات جديدة في واحدة من أمشاج الأبوين. وتمثل الطفرات التلقائية حوالي 33٪ من جميع حالات الناعور أ، وحوالي 30٪ من حالات الناعور ب. كان من المستحيل تحديد ما إذا كانت الأم هي الحاملة للمرض أم السبب طفرة حتى ظهور اختبار الحمض النووي المباشر الحديث.
شدة المرضهناك العديد من الطفرات المختلفة التي تسبب كل نوع من الهيموفيليا أ، ب أو ج. بسبب الاختلافات في التغييرات الجينية، مرضى الهيموفيليا لديهم مستوى معيّن من عامل التخثّر. عندما يكون عامل التخثر أقل من 1 % تصنّف الحالة بالهيموفيليا الشديدة. في حال كان من 1-5% تصنّف هذه الحالة بالهيموفيليا المتوسطة أما عندما يكون عامل التخثر طبيعي بين 5-40% تصنّف الحالة بالهيموفيليا المعتدلة.
التشخيصيمكن للناعور أن يشابه مرض فون ويلبراند.
حيث أن انخفاض مستويات عامل فون ويلبراند يمكن أن يؤدي إلى التحلل البروتيني للعامل الثامن. بالإضافة إلى أن الحالات الشديدة من نقص فيتامين K قد تُظهر أعراضًا مشابهة لمرض سيولة الدم. وذلك لأن فيتامين K ضروري لجسم الإنسان لإنتاج عدة عوامل تخثُّر. نقص الفيتامين أمر نادر الحدوث في البالغين والأطفال الأكبر سنًا لكنَّه شائع في حديثي الولادة. يولد الأطفال الرضع لديهم مستويات منخفضة بشكل طبيعي من فيتامين K وليس لديهم حتى الآن بكتيريا الأمعاء التي تقوم بتخليق فيتامين k, يعرف هذا باسم «مرض نزف حديثي الولادة». ولتجنب هذه المضاعفات، يتم حقن حديثي الولادة بصورة روتينية بمكملات فيتامين K.
العلاج

العامل الثامن
لوقف النزيف يُنصح باستخدام الثلج الموضعي عند حدوث أي نزيف خاصة بالمفاصل مع أخذ مسكنات للآلام. على الرغم من أنه لا يوجد علاج لمرض سيولة الدم، إلا أنه يمكن السيطرة عليه بالحقن العادية لعامل التخثر الناقص، أي العامل الثامن في الناعور أ أو العامل التاسع في الناعور ب. يتم إعطاء الطفل بروتين التجلط المناسب عن طريق الوريد كل 12 ساعة لمدة يومين أو ثلاثة أيام ليساعد الدم علي التجلط وهناك العديد من مشتقات البلازما التي يمكن استخدامها في هذه الحالات وإن كانت بروتينات التجلط التي يتم تصنيعها باستخدام الهندسة الوراثية تعتبر أفضل من البلازما التي قد ينتج عنها انتقال بعض الأمراض مثل التهاب الكبد سي. يكوّن بعض مرضى الهيموفيليا أجسام مضادة (مثبطات) ضد العوامل المُستبدلة المعطاة لهم، وبالتالي فلابد من زيادة كمية العامل لابد من زيادة أو تُعطى المنتجات البديلة غير البشرية، مثل العامل الثامن المُصنَّع من الخنازير. في أوائل عام 2008، وافقت إدارة الغذاء والدواء الأمريكية على (وايث) عامل مضاد للهيموفيليا مُصنَّع بالهندسة الوراثية من جينات من خلايا مبيض الهامستر الصيني. منذ عام 1993 استخدمت على نطاق واسع في الدول الغربية الغنية منتجات عامل التخثر الغير بشرية التي توفر أعلى نقاء وسلامة، لكنَّها مكلفة للغاية فلم تتوافر في العالم النامي. ومن الصعب الحصول على منتجات العوامل من أي نوع في البلدان النامية. وهناك العلاج الوقائي عن طريق حقن الطفل المريض كل 48 ساعة بمعاملات التجلط ورغم أنه يتكلف أكثر من العلاج بالبلازما لكنه يفيد في الحفاظ على المفاصل والعضلات في حالتها الطبيعية حتى لا تحدث أي إعاقة للطفل.
العلاج الجينيو أفضل ما يعالج به مريض الهيموفيليا هو العلاج بالجينات مرة واحدة فتكفيه لمدة عام، ويمكن تفادي الانتقال الوراثي للمرض عن طريق إجراء تحاليل قبل الزواج أو الحمل إذا كان الزوج مريضاً أو في حالة وجود طفل مصاب في أسرة الإناث المقبلات على الزواج؛ عليهم قياس نسبة الخلل في الجينات وسرعة التجلط وقياس بروتينات التجلط (8) و (9), في حالة حدوث حمل يتم تحديد نوع الجنين فإذا كان أنثى يستمر الحمل أما إذا كان ذكرًا فيتم عمل تحاليل للدم في الخلايا الموجودة في السائل الأمينوسي وتحليل الجينات حتى نتجنب إعاقة الأطفال.</ref>
تمارين وقائيةمن المستحسن أن يقوم الأشخاص المصابين بالهيموفيليا بتمارين محددة لتعزيز المفاصل خاصةً المرفقين، الركبتين والكاحلين. يُوصى بهذه التدريبات يوميًا لتقوية العضلات وبعد النزيف الداخلي خصوصًا لمنع مشاكل النزيف من جديد. من التدريبات: الإحماء، دوائر الكاحل، انحناء الكوع وتمديد عضلات الفخذ.
المحظوراتيُمنع استخدام مضادات التخثر مثل الهيبارين والوارفارين للأشخاص الذين يعانون من الناعور حيث أنها يمكن أن تؤدي إلى تفاقم الحالة. ويُمنع أيضًا الأدوية التي تسبب «سيولة الدم» كآثار جانبية. على سبيل المثال، الأسبرين والايبوبروفين، أو الصوديوم نابروكسين حيث تؤدي إلى إطالة زمن النزيف.كما يجب تجنب الأنشطة التي يُحتمل التعرض فيها للإصابة، مثل الدراجات النارية والتزلج. الرياضات ذات المعدلات العالية من الاتصال الجسدي والإصابات مثل كرة القدم الأميركية والهوكي والملاكمة والمصارعة، كرة القدم والبيسبول وكرة السلة.
علم الأوبئةالناعور مرض نادر، فقط حوالي 1 في كل 10000 ولادة (أو 1 في كل 5000 من الذكور) الناعور أ 1 في كل 50000 ولادة، الناعور ب 1 من كل 18000 شخص في الولايات المتحدة. كل سنة في الولايات المتحدة، يولد حوالي 400 طفل مصاب بهذا المرض.
اكتشاف علمي كان أبوالقاسم الزهراوي أول متخصص طبي يصف المرض. في القرن العاشر وصف الأسر التي توفى ذكورها من نزيف بعد صدمات طفيفة. لكن لم يبدأ التحليل العلمي حتى بداية القرن التاسع عشر. عام 1803، كتب طبيب من فيلادلفيا يدعى جون كنارد أوتو مقالة عن «ميل للنزيف يوجد في عائلات معينة». وقد أدرك أن الحالة كانت وراثية وتؤثر على الذكور فقط انتقالًا عبر إناث صحيحات. وكانت ورقته هي الورقة الثانية لوصف خصائص مهمة لاضطراب وراثي مرتبط بالصبغي X (الورقة الأولى كانت في وصف عمى الألوان من قبل جون دالتون الذي درس عائلته). وُصف المرض عام 1813 من قبل جون هاي، حيث نشر مقالة في الصحيفة الطبية بنيو انغلاند.في عام 1924، اكتشف طبيب فنلندي اضطراب نزيف وراثي مماثل لمرض الهيموفيليا في «جزر آلاند»، جنوب غرب فنلندا، ويسمى هذا الاضطراب «مرض فون فيلبراند». وقد ظهرت كلمة «هيموفيليا» أول مرة في وصف هذا المرض سنة 1828م حيث كتبها عالم يدعى هوبف في جامعة زيورخ.
وفي عام 1947 وجد طبيب من بوينس آيرس، أن الناعور نوعين أ وب وهما مرضان منفصلان.
العائلة المالكة الأوروبية
الملكة فيكتوريا
نقلت الملكة فيكتوريا مرض الناعور (الهيموفيليا)) إلى ذريتها.
يسمى نزف الدم الوراثي أيضًا بـ«المرض الملكي» لأنه كان سائداً عند عوائل الأُسر الحاكمة. نقلت الملكة فكتوريا
المرض إلى ابنها، وعن طريق بناتها انتقل هذا المرض إلى العوائل الحاكمة عبر القارات، ومنهم الأُسر الحاكمة في إسبانيا وألمانيا وروسيا.
وزعم راسبوتين أنه كان ناجحًا في علاج الهيموفيليا التي أصيب بها أحد ملوك روسيا، اليكسي ابن نيقولا الثاني. في ذلك الوقت، كانت العلاج مشتركًا من قبل الأطباء وهو استخدام الأسبرين، الذي أدى إلى تفاقم الحالة بدلًا من تقليلها. وببساطة عن طريق تقديم النصح ضد العلاج الطبي، راسبوتين تمكن من تحقيق تحسن ملحوظ وكبير في حالة اليكسي.
في إسبانيا، حفيدة الملكة فيكتوريا من خلال ابنتها الأميرة بياتريس، الأميرة فيكتوريا أوجيني من باتنبرغ أصبحت فيما بعد ملكة إسبانيا. وكان اثنان من أبنائها مصابين بنزف الدم وكلاهما مات من حوادث سيارات بسيطة. توفي ابنها الأكبر، ألفونسو، أمير أستورياس، عن عمر يناهز ال 31 من نزيف داخلي بعد أن اصطدمت سيارته بكشك هاتف. وأيضا أصغر أبنائها، إنفانتي غونزالو، توفي في سن 19 من نزيف في البطن إثر حادث سيارة بسيط حيث اصطدم هو وأخته بجدار أثناء محاولة تجنب دراجة. وتوفى غونزالو بعد يومين من نزيف داخلي دون أن يبدو مصابًا أو يسعى للرعاية الطبية العاجلة.
قضايا تلوث الدمقبل عام 1985، لم تكن هناك قوانين سنت في الولايات المتحدة لفحص الدم. ونتيجة لذلك، كان الكثير من الناس المصابين بالناعور في خطر شديد للإصابة بفيروس نقص المناعة البشرية والتهاب الكبد الوبائي عن طريق منتجات الدم. وتشير التقديرات إلى أن أكثر من 50٪ من السكان المصابين بالناعور، أي أكثر من 10,000 شخص، أصيبوا بفيروس نقص المناعة البشرية في الولايات المتحدة وحدها. في أواخر السبعينات وأوائل / منتصف الثمانينات، وُضعت أساليب جديدة في إنتاج عوامل التجلط. مثل البسترة والمعالجة الحرارية.
======
فرفرية قليلة الصفيحات مجهولة السبب من ويكيبيديا، الموسوعة الحرة
فرفرية قليلة الصفيحات مجهولة السبب

معلومات عامة
الاختصاص علم الدم
من أنواع قلة الصفيحات الأولية
، وفرفرية قليلة الصفيحات، ومرض
الأدوية== فينبلاستين، وآزاثيوبرين، وسيكلوفوسفاميد
نقلت الملكة فيكتوريا مرض الناعور (الهيموفيليا)) إلى ذريتها.
يسمى نزف الدم الوراثي أيضًا بـ«المرض الملكي» لأنه كان سائداً عند عوائل الأُسر الحاكمة. نقلت الملكة فكتوريا
المرض إلى ابنها، وعن طريق بناتها انتقل هذا المرض إلى العوائل الحاكمة عبر القارات، ومنهم الأُسر الحاكمة في إسبانيا وألمانيا وروسيا.
وزعم راسبوتين أنه كان ناجحًا في علاج الهيموفيليا التي أصيب بها أحد ملوك روسيا، اليكسي ابن نيقولا الثاني. في ذلك الوقت، كانت العلاج مشتركًا من قبل الأطباء وهو استخدام الأسبرين، الذي أدى إلى تفاقم الحالة بدلًا من تقليلها. وببساطة عن طريق تقديم النصح ضد العلاج الطبي، راسبوتين تمكن من تحقيق تحسن ملحوظ وكبير في حالة اليكسي.
في إسبانيا، حفيدة الملكة فيكتوريا من خلال ابنتها الأميرة بياتريس، الأميرة فيكتوريا أوجيني من باتنبرغ أصبحت فيما بعد ملكة إسبانيا. وكان اثنان من أبنائها مصابين بنزف الدم وكلاهما مات من حوادث سيارات بسيطة. توفي ابنها الأكبر، ألفونسو، أمير أستورياس، عن عمر يناهز ال 31 من نزيف داخلي بعد أن اصطدمت سيارته بكشك هاتف. وأيضا أصغر أبنائها، إنفانتي غونزالو، توفي في سن 19 من نزيف في البطن إثر حادث سيارة بسيط حيث اصطدم هو وأخته بجدار أثناء محاولة تجنب دراجة. وتوفى غونزالو بعد يومين من نزيف داخلي دون أن يبدو مصابًا أو يسعى للرعاية الطبية العاجلة.
قضايا تلوث الدمقبل عام 1985، لم تكن هناك قوانين سنت في الولايات المتحدة لفحص الدم. ونتيجة لذلك، كان الكثير من الناس المصابين بالناعور في خطر شديد للإصابة بفيروس نقص المناعة البشرية والتهاب الكبد الوبائي عن طريق منتجات الدم. وتشير التقديرات إلى أن أكثر من 50٪ من السكان المصابين بالناعور، أي أكثر من 10,000 شخص، أصيبوا بفيروس نقص المناعة البشرية في الولايات المتحدة وحدها. في أواخر السبعينات وأوائل / منتصف الثمانينات، وُضعت أساليب جديدة في إنتاج عوامل التجلط. مثل البسترة والمعالجة الحرارية.
======
فرفرية قليلة الصفيحات مجهولة السبب من ويكيبيديا، الموسوعة الحرة
فرفرية قليلة الصفيحات مجهولة السبب

معلومات عامة
الاختصاص علم الدم
من أنواع قلة الصفيحات الأولية
، وفرفرية قليلة الصفيحات، ومرض
الأدوية== فينبلاستين، وآزاثيوبرين، وسيكلوفوسفاميد
فرفرية قليلة الصفيحات مجهولة السبب أو قلة الصفيحات المناعي أو قلة الصفيحات المجهول السبب (بالإنجليزية: Idiopathic thrombocytopenic purpura) هي مرض مناعي ذاتي يؤدي إلى نقص في الصفائح الدموية وينتشر لدى النساء بشكل أكبر.
الأسباب
وفي الحقيقة أنه في كثير من الأحيان لا يعرف سبب مباشر لحدوث تلك الحالة ولكننا نعرف بعض الأمور التي ينتج عنها هذا الأشكال مثل التطعيمات الفيروسية أحيانا، وفيروسات الزكام والجدري الماء وغيرها، إضافة إلى أن هناك حالات مرضية مثل الذئبة الحمراء وخلل الجهاز المناعي (مثل أمراض المناعة الذاتية) كما أنها قد تنتج أيضا عن تناول بعض الأدوية دون استشارة الطبيب.
التشخيص
يتم التشخيص عن طريق استبعاد الأمراض الأخرى المسببة لقلة الصفيحات الدموية مثل: نقص الصفيحات المحرض بالأدوية: وهناك بعض الأدوية قد تؤدي إلى نقص في الصفيحات أدوية الصرع وأدوية السلفا وأدوية الروماتيزم وبعض المضادات الحيوية.
المتلازمة الانحلالية اليوريميائية: وهذا المرض يحدث في الأطفال الرضع والطفولة الباكرة ويظهر هذا المرض على شكل التهاب معدة وإمعاء حاد يتمثل بإسهال وقيء ثم يتلو ذلك أعراض فقر دم انحلالي ونقص في الصفيحات وقصور كلوي حاد يمكن أن يؤدي إلى فشل كلوي، وقد توجد بعض الأعراض العصبية، هذا ما يرعب الأطباء حينما يصاب الطفل بإسهال وقيء فهم يخافون إصابتهم بهذه المضاعفات الخطيرة.
فرفرية نقص الصفيحات التخثرية: في هذا يحدث خثرات (تجلطات) في الأوعية الصغيرة وحين تصيب المخ تؤدي إلى تبدلات في المزاج والتوجه وربما إلى عدم الإبصار وتشنجات.
متلازمة كاسباخ - ميريت: وهي عبارة عن ورم وعائي دموي كبير مع تخثر موضع داخل الأوعية مسبباً نقصًا في عدد الصفيحات وهذا الورم الوعائي ربما يكون داخلياً يصعب اكتشافه. ومن المضاعفات الأخرى لهذا المرض قصور في القلب وعلاجها يعتمد على شدة وضخامة الورم ويتخدل الجراح والاشعة والليزر في العلاج.
التشظي Sequestration: يحدث نقص في عدد الصفيحات نتيجة لضخامة الطحال الشديدة.
الأعراض

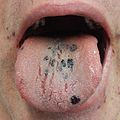
طفح جلدي بسبب نقص الصفائح في القدم
أغلب من يعانون من نقص في الصفيحات الدموية التجلط لا يعانون من أية أعراض، ولكن عندما يصبح عدد صفائح الدم منخفضًا جدًا، يكون العرض الرئيسي هو طفح جلدي مميز من بقع حمراء ارجوانية اللون غالبًا ما تكون على الكاحلين والقدمين.كما يمكن أن يسبب نقص خلايا التجلط حدوث نزيف متكرر من الانف وسهولة في حدوث الكدمات وكثافة دورات الحيض في النساء، قد يكون النزف زائداً وتصعب السيطرة عليه.
يمكن أيضًا أن يحدث نزيف داخلي خطير مثل داخل المخ، أو نزيف من المعدة إذا انخفض عدد الصفيحات إلى مستويات متدنية جدًا أقل من 10 آلاف، في حين أن العدد الطبيعي يتراوح من 150 ألف إلى 400 ألف صفيحة.
العلاج
إذا لاحظت أي نزيف غير طبيعي أو ظهر لديك طفح جلدي من بقع حمراء ارجوانية اللون، فإذهب إلى الطبيب. سوف يجري لك اختبارات للدم لقياس مستوى الصفائح الدموية لديك ومستوى خلايا الدم الأخرى. نظراً لأن الكثير من العقاقير المختلفة يمكن أن تسبب تلك الحالة، فقد ينصحك الطبيب بالتوقف عن تناول عقاقير معينة مما تصرف بتذكرة طبية.
إذا كان يبدو أن جهازك المناعي هو الذي يسبب المرض، فقد يصف لك الطبيب عقاقير القشرة الكظرية لتثبيط رد الفعل المناعي الذاتي. أما إذا كانت حالتك خطيرة ولم تسعفك الادوية فلا مناص من اللجوء إلى جراحة استئصال الطحال لمنع الطحال من تدمير الصفائح الدموية.
يبدأ علاج نقص التجلط الثانوي بالتخلص من الحالة المسببة أو بإيقاف الأدوية المسببة لهذا المرض.
قد لا يكون العلاج ضروريًا إذا لم يكن ثمة اعراض، وهو الحال الكائن في الأطفال غالبًا. لكن إذا انخفضت عدد صفائح الدم إلى اقل من مستوى معين، فإن خطر حدوث النزيف يكون كبيرًا جداً لدرجة أنك ستحتاج إلى نقل للصفائح الدموية إليك.
توجد مادة طبيعية جديدة في استخدامها للعلاج تسمى ثرومبوبوييتين (أي المادة المكونة أو المنشطة لتكون خلايا التجلط أو الصفائح الدموية) وهي كفيلة بجعل عدد الصفائح يرتفع وقد تحل محل نقل الصفائح الدموية
1- المواد الكورتيزونية: وتستخدم في الحالات الحادة والمزمنة، ووجد كما ذكرنا أنها ترفع عدد الصفيحات بشكل أسرع من الذين لم يتم علاجهم، ولكن هناك خطورة من استخدامها لمدة طويلة، كما يجب إيقافها بشكل تدريجي وهنا تفاصيل كيفية العلاج ويترك للطبيب المعالج.
2- القلوبولينات المناعية الوريدية: وهذه المادة لها تأثير سريع وعجيب في رفع عدد الصفيحات بشكل سريع في بعض الحالات، وهذا العلاج باهظ الثمن، وله بعض المساوئ والمضاعفات مثل الصداع والقيء، وفي بعض الأحيان وهذا نادر بسبب الاحتياطات التي تعمل من قبل المختبرات ينقل بعض الأمراض الخطيرة.
3- المعالجة بالـ ANTI-D وريديًا: وهذا العلاج لا يزال هناك جدل وبحث في استخدامه.
معرض صور


انظر أيضًاقلة الصفيحات-أونياليا
==
ابيضاض الدم//من ويكيبيديا، الموسوعة الحرة
ابْيِضَاضُ الدَّم؛ لوكيميا
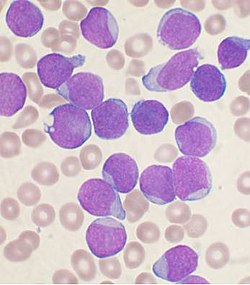
لُطاخَةُ من نخاع العظم مصبوغة بصبغة رايت "Wright's" لشخص يعاني من ابْيِضاضُ الأَرُوْمَاتِ اللِّمْفَاوِيَّة الحاد مع السلائف الخلايا البائية.
الاختصاص علم الدم وعلم الأورام
من أنواع سرطان دموي
، ومرض تكاثر نقوي، ومرض
المظهر السريري
الأعراض آلام العظم، ودوخة، وفقدان الوزن، وألم الصدر، ووذمة، وذبحة صدرية
الإدارة
أدوية{{{ميثوتركسيت، وسيتارابين، وفينكريستين، وبيبوبرومان، وإرينوتيكان، وآيزوتريتينوين، وليناليدوميد، ونيلوتينيب، وإبروتينيب
، وروكسوليتينيب، وإيماتينب، وبوسوتينيب
، وريتوكسيماب
=====
ابيضاض الدَّم أو اللوكيميا (بالإنجليزية: Leukemia) هو عبارة عن مرض خبيث للجملة المكونة للدم ويتصف بزيادة عدد الكريات البيضاء غير النَّاضجة في الدَّم ونقي العظم. في دراسة أجرتها مجموعة الشرق الأوسط لأبحاث السرطان أظهرت إصابة 515 شخص في مصر ما بين العامين 1999-2001 و1354 شخص في الأردن بابيضاض الدم ما بين عامي 1996-2001. ويسمَّى أيضاً باللوكيميا أو سرطان الدم يبدأ هذا المرض في نخاع العظام وينتشر إلى الأجزاء الأخرى من الجسم.سرطان الدم هو مجموعة من الأورام الخبيثة التي تبدأ عادة في نخاع العظم وتتميز بعدد مرتفع من خلايا الدم البيضاء غير الطبيعية. وهذه الخلايا الناتجة تكون غير ناضجة تماماً وتسمى الأورمة. والأعراض هي نزيف، رضَّات (تكدُّمات)، الشعور بالتعب، ارتفاع درجة الحرارة وزيادة خطر الإصابة بالالتهابات. هذه الأعراض هي نتيجة نقص خلايا الدَّم الطبيعية ويتم التشخيص عن طريق فحوص الدم أو خزعة من نسيج العظم. سبب سرطان الدَّم غير معروف ويختلف السَّبب باختلاف نوع سرطان الدم. تلعب العوامل الوراثية والظروف البيئية دوراً في الإصابة بسرطان الدم. العوامل التي تزيد فرصة حدوث سرطان الدم هي التدخين والإشعاع الأيوني وبعض المواد الكيميائية مثل حلقة البنزين أو في حال الخضوع لعلاج كيميائي مسبق ومتلازمة داون. كما أنَّ الأشخاص الذين لديهم تاريخ عائلي بمرض سرطان الدم تزداد نسبة إصابتهم. يوجد أربعة أنواع رئيسية لسرطان الدم وهي سرطان الدم الليمفاوي المزمن، سرطان الدم النخاعي الحاد، سرطان الدم الليمفاوي الحاد، سرطان الدم النخاعي المزمن وهنالكَ أنواع أخرى ولكن غير شائعة. سرطان الدم وسرطان الغدد الليمفاوية يندرجان تحت نوع السرطان الذي يؤثر على الدم ونخاع العظم ونظام الغدد الليمفاوية وتسمى بأورام مكونات الدم والأنسجة الليمفاوية. علاج سرطان الدم يتضمَّن مزيج من العلاج الكيميائي والإشعاعي والعلاج المُستهدف وزرع نخاع العظم والرعاية المساندة والمسكنة للآلام. بعض أنواع سرطان الدم الانتظار اليقظ. نجاح العلاج يعتمد على نوع سرطان الدم وعمر المصاب. نتائج العلاج متطورة في البلدان المتقدمة. معدل عيش المصابين لمدة 5-سنوات هو 57% بالولايات المتحدة. الأطفال الذينَ يقلُّ عمرهم عن 15 سنة معدل النجاة لمدة 5-سنوات يقاس 60-85% بالاعتماد على نوع السرطان. إنَّ الأطفال الذين أُصيبوا بسرطان الدم الحاد ثم تعالجوا وبقوا أصحَّاء لمدة 5-سنوات هم في الأغلب لن يعانوا من عودة السرطان مرة أخرى. عام 2012 ,352 ألف شخص أُصيبوا بسرطان الدم حول العالم وأدَّى ذلك إلى وفاة 265 ألف حالة. يعتبر سرطان الدم هو الأكثر شيوعاً بين الأطفال، ثلاثة أرباع الأطفال المصابينَ مصابينَ بنوع سرطان الدم الحاد. ومع ذلك، فإنَّ 90% من سرطان الدم يتم تشخيصه بالبالغينَ وغالباً يكون النوع سرطان الدم المزمن أو سرطان الغدد الليمفاوية الحاد. وأعلى نسب تكون في البلدان المتقدمة.
التصنيف
التصنيف العام
أنواع سرطان الدم \ تصنيفاتهم:
أربعة أنواع رئيسية لابيضاض الدم نوع الخلية حاد مزمن
ابيضاض دم لمفاوي
(أو "ابيضاض الأرومات اللمفاوية") ابيضاض الدم الليمفاوي الحاد
(ALL) ابيضاض الدم الليمفاوي المزمن (CLL)
ابيضاض الدم النقوي الحاد
(AML أو الأرومات النقوية) ابيضاض الدم النقوي المزمن
(CML) ابيضاض دم نقوي
("نخاعي" أو "غير لمفاوي")
سرطان الدم يُصنَّفُ سريريَّاً ومرضيَّاً إلى عدة أنواع وأوًل نوع يتضمَّن حدة المرض (حاد، مزمن): السرطان الحاد يتصف بزيادة في عدد خلايا الدم غير الناضجة ممَّا يجعل نخاع العظم مزدحم بهذه الخلايا فتقل قدرته على إنتاج خلايا طبيعية. سرطان الدم الحاد يتطلب علاج فوري بسبب التطور السريع وتجمع الخلايا السرطانية التي تخرج من الدم وتنتشر إلى أعضاء أخرى. إنَّ سرطان الدم الحاد هو الأكثر شيوعا بين الأطفال.
السرطان المزمن يتصف بوجود عدد كبير من الخلايا البيضاء الناضجة نسبياً ولكنها تمتلك شكلا غير طبيعي. خلايا الدم البيضاء في العادة تحتاج إلى شهور أو سنوات لتنضج ولكن في هذه الحالة خلايا الدم البيضاء تنتج بسرعة عالية مما يؤدي إلى وجود عدد كبير من خلايا البيضاء غير الطبيعية. يستلزم سرطان الدم الحاد معالجة فورية، بينما سرطان الدم المزمن يستلزم مراقبة لفترة معينة قبل تطبيق العلاج وذلك لضمان التأثير الأكبر الممكن للمعالجة. سرطان الدم المزمن عادةً يصيب كبار السن ومن الممكن أنْ يحصل أيضاً ضمن أيِّ فئة عمرية.
بالإضافة إلى أنَّه يمكن تقسيم سرطان الدم حسب نوع خلية الدم المتأثرة، فيتم تقسيم سرطان الدم إلى سرطان الأنسجة الليمفاوية وسرطان نخاع العظم. في سرطان الأنسجة الليمفاوية، التغيُّر السرطاني يحدث في نوع من خلايا النخاع العظمي والتي عادةً ما تتحول أو تُكوِّن خلايا الليمف والتي تُعد خلايا مناعية تهاجم المرض؛ أغلب سرطانات الأنسجة الليمفاوية تحتوي على نوع بيتا من خلايا الليمف.
في سرطان نخاع الدم، يحدث التغير السرطاني في خلايا نخاع العظم التي تُكوِّن عادة خلايا الدم الحمراء، وبعض أنواع خلايا الدم البيضاء والصفائح الدموية.
الجمع بين هذين التصنيفين يوفِّر أربع فئات رئيسية. داخل كل فئة من هذه الفئات الرئيسية هناك عادةً عدَّة فئات فرعية. وأخيراً، تُعتبر بعض الأنواع نادرةً وعادةً ما تكون خارج نظام هذا التصنيف.
أنواع خاصة
ابيضاض الدم الليمفاوي الحاد (ALL) هي أكثر الأنواع شيوعاً في الأطفال، كما أنَّه يصيب البالغين خصوصاً الذين تزيد أعمارهم عن 65 سنة. العلاج يتضمَّن علاج كيميائي وإشعاعي. معدل النَّجاة يختلف حسب عمر المريض 85% عند الأطفال و50% عند البالغين.
فروع هذا النوع هي سرطان النسيج اللمفاوي الحاد لخلايا B ، سرطان النسيج اللمفاوي الحاد لخلاياT، سرطان البيركت، سرطان الدم الحاد الذي له تمثيلان شكليان.
ابيضاض الدم الليمفاوي المزمن (CLL) والذي غالباً ما يصيب البالغين فوق جيل 55. وغالباً ما يصيب البالغين ولا يصيب الأطفال، وثلثي الأشخاص المصابين هم من الذكور. معدل النجاة لمدة 5 سنوات هو 75%.
السرطان المزمن غير قابل للشفاء، ولكنْ هنالكَ العديد من العلاجات الفعَّآلة. ولسرطان الدم المزمن يوجد تصنيف فرعي واحد وهو ابيضاض خلايا السليفة الليمفاوية ب والذي يعتبر مرض أكثر عدوانية.
ابيضاض الدم النقوي الحاد (AML) عادةً يصيب البالغين أكثر من الأطفال كما أنَّه يصيب الذكور أكثر من الإناث. يمكن علاجه بالعلاج الكيميائي. معدل النجاة لمدة 5 سنوات هي 40% ما عدا سرطان الدم الحاد البرولمفوسين الذي يمثل نسبة 90%.
فروع ابيضاض الدم النقويّ الحاد هي سرطان الدم البرولمفوسايت الحاد، سرطان الدم الميوبلاستي الحاد الذي يؤثر على الخلايا العضلية الجذعية وmegakaryoblastic leukemia.
ابيضاض الدم النقوي المزمن (CML) يحدث غالباً في البالغين ويصيب عدد قليل جدا من الأطفال. يتم علاجه بدواء Lmatnib أو أدوية أخرى. معدل النجاة لخمس سنوات 90%.
وله فرع واحد هو Chomic myelommocytic leukemia.
سرطان الدم الزغبي (سرطان الدم بالخلايا المشعرة)Hairy cell leukemia)HCL) هو نوع من أنواع سرطان الخلايا الليمفية المزمن، ولكنَّه لا يتناسب تماماً مع هذه الفئة. 80% من المصابين هم ذكور بالغين.لم يُذكر أنَّه تمَّ تسجيل أيِّ حالة في الأطفال.يوجد علاجات له لكن لا يمكن الشفاء منه. معدل النجاة من 96 إلى 100% خلالَ عشر سنوات.(T-PLL) (Tcell prolymphocytic leukemia) هو مرضٌ نادرٌ جدَّاً وخطير ويؤثر على البالغين وغالباً تأثيره على الذكور أكثر من الإناث. بالرغم من نُدرته، إلّا أنَّه الأكثر شيوعا من سرطانات الدم التي تُصيب خلايا ال Tcell,
أغلب أنواع سرطانات الدم تؤثر على ال Bcel. يصعب علاجه ومعدل النجاة يقاس بالأشهر فقط.
سرطان الدم الليمفي الذي يصيب الحبيبات الكبيرة وهي إمَّا تحوي Tcell أو NKcells، هو مرض نادر مثل سرطان الدم الزغبي، والذي يحدث فقط في الخلايا B وهو غير عدواني.سرطان الدم الي يصيب خلايا T البالغة. هو ناتج عن فيروس يسمى بالفيروس البشري الذي يصيب Tcell (HTLV) وهو فيروس شبيه بل HIV؛ حيثُ كلاهما يصيب خلايا CD4+ Tcell ويتضاعف فيها. على أيَّة حالٍ، هو يختلف عن فيروس HIV في كونه لا يدمِّر هذه الخلايا. بدلاً من ذلك، HTLV «يُخلِّد» خلايا T المصابة، مما يتيح لهم القدرة على التكاثر بشكل غير طبيعي. فيروس خلية T البشرية النوعين الأول والثاني منه (HTLV-I / II) مُستوطنة في مناطق مُحددة في العالم.
الأعراض والعلامات

أعراض شائعة لابيضاض الدم المزمن أو الحاد
في سرطان الدم يتم استبدال خلايا نخاع العظم الطبيعية بأعدادٍ كبيرة من خلايا الدم البيضاء غير النَّاضجة ممَّا يُؤدِّي إلى تحطيم نخاع العظم ونتيجة لذلك يقل عدد الصفائح الدموية التي تساعد في الوضع الطبيعي في عملية تجلُّط الدم. مما يعني أنَّ الأشخاص المصابين يصابون بكدمات بسهولة ويعانون من النزيف الزائد ويتكون لديهم نزيف على سطح الجلد أو ما يُسمَّى بالنمشات. خلايا الدم البيضاء (المسؤولة عن محاربة الكائنات الممرضة). سيقل عددها أو ستخسر وظيفتها الطبيعية. مما يؤدي إلى ضعفٍ بالجهاز المناعي فيصبح غير قادر على مواجهة الالتهابات البسيطة أو يبدأ بمحاربة خلايا الجسم الأخرى. يعاني مصاب سرطان الدم من الاتهابات المتكررة بسبب ضعف جهاز المناعة وهذه الالتهابات تتراوح بين التهاب اللوزين أو قرحة بالفم أو الإسهال إلى الالتهاب الرئوي أو الالتهابات بالكائنات الانتهازية. كما أنَّ عدد خلايا الدم الحمراء يقل مما يؤدي إلى فقر الدم والتي بدورها تسبب الشحوب وقصر النفس. بعض المصابين يعانون من أعراض أخرى مثل الشعور بالمرض، ارتفاع درجة الحرارة، التعرُّق خلال الليل، الشعور بالإرهاق وأعراض أُخرى تُشابه الأعراض المُصاحبة للإنفونزا. كما من الممكن أن يشعر الشخص بالغثيان والامتلاء بسبب تضخم الكبد والطحال مما يؤدي إلى نقص الوزن غير المقصود. الخلايا غير النَّاضجة قد تتجمع وتشكل انتفاخ بالكبد أو العقد الليمفية ممَّا يؤدِّي إلى الشعور بالألم وتؤدي إلى الشعور بالغثيان.
إذا اجتاحت الخلايا السرطانية الجهاز العصبي المركزي ستظهر أعراض وعلامات عصبية أهمّها الصداع. ومن الأعراض الأخرى: الصداع النصفي والتشنجات العصبية كما أنَّ ارتفاع الضغط على جذع الدماغ يؤدي إلى حدوث حالات الإغماء. يُذكر أنَّ جميع هذه الأعراض قد ترتبط بأمراض أخرى ولهذا سرطان الدم يتم تشخيصه عن طريق فحوص طبية. كلمة سرطان الدم (تعني ابيضاض الدم) مشتقة من وجود أعداد كبيرة من خلايا الدم البيضاء. تظهر هذه الأعداد عند فحص عينة من الدم باستخدام المجهر. وتكون هذه الخلايا الزائدة ذات أشكال غير طبيعية أو وظيفة غير طبيعية. كما أنَّ وجود عدد كبير من خلايا الدم البيضاء يؤثِّر على أعداد خلايا الدم الأُخرى مما يؤدي إلى اختلال في توازن كمية الدم.
بعض المصابين بسرطان الدم لا يكون عندهم ارتفاع في خلايا الدم البيضاء عند إجراء فحص تعداد الدم وهذه الحالة تسمى ندرة الكريات البيض (aleukemia) وفي هذه الحالة يحتوي نخاع العظم على خلايا دم بيضاء سرطانية تعمل على تدمير الخلايا الطبيعية المسؤولة عن إنتاج خلايا الدم ، أما الخلايا السرطانية نفسها تبقى في نخاع العظم بدلاً من الخروج إلى الدم. من الممكن أن يحدث ندرة الكريات البيض في الأربع أنواع السابقة من سرطان الدم ولكن الأكثر شيوعاً هو مُصاحباً لسرطان الدمي الزغبي.
إن امتلاء نخاع العظم بالخلايا السرطانية يثبط عملية بناء خلايا دم طبيعية مما يؤدي إلى نقص في كريات الدم الحمراء (أنيميا) وقصٍ في الصفائح الدموية، والتي تلعب دوراً أساسيَّاً في عملية تخثر الدم. من هنا، قد يعاني مرضى ابيضاض الدم من النزيف الذي غالبًا ما يحدث في اللثة، أو سطح الجلد ويظهر كبقع نزف صغيرة تحت الجلد بحجم رأس الإبرة تُعرف باسم الحبرات.
الأسباب لا يوجد سبب محدد لهذا السرطان، يوجد بضعة أسباب تسبب بضعة أنواع منه. السبب وراء أغلب أنواعه غير معروف، قد تكون الاسباب بسبب التاريخ العائلي للمرض والإشعاع المؤين والعلاج الكيميائي، ويختلف السبب باختلاف نوع السرطان. سرطان الدم ينتج عن طفرة بالمادة الوراثية من خلال تفعيل الجينات المسرطنة أو تعطيل الجينات الكابتة للورم وبالتالي تعطيل تنظيم موت الخلايا، والتمايز أو التقسيم هذه الخطوات من الممكن أن تحدث تلقائيَّاً (أي بدون أي مؤثر خارجي) أو من الممكن أنْ تحدث بسبب التعرُّض لإشعاع أيوني أو مواد مسرطنة . تعد الإشعاعات الأيونية الطبيعية والصناعية هي السبب الأكثر شيوعاً في البالغين كما أنَّ بعض الفيروسات كالفيروس البشري للنسيج اللمفاوي وبعض الكيماويات خصوصاً البنزين والمعالجة القاعدية الكيميائية قد تؤدي إلى هذا السرطان. إنَّ التدخين يزيد خطورة الإصابة بسرطان الدم النخاعي الحاد عند البالغين بنسبة بسيطة. من خلال بعض الدراسات مثل دراستي كوهورت و(حالة-تحكم) تم ربط التعرض لبعض الكيماويات البترولية وصبغات الشعر بالإصابة بسرطان الدم. إنَّ النِّظام الغذائي ليس له دور في الإصابة لكن تناول الخضروات قد يحمي. الفيروسات التي تمَّ إعازتها لهذا السرطان ومنها الفيروس البشري للنسيج Tاللمفاوي الذي يسبب سرطان الدم لخلايا T الليمفاوية البالغة. بعض الأفراد لديهم عامل وراثي لتطوُّر سرطان الدم والذي يُحدَّد عن طريق تاريخ العائلة ودراسات توين Twin study. إنَّ الناس المصابين لديهم جين واحد أو عدة جينات مشتركة. في بعض العائلات، الأفراد يصابون بنفس النوع من سرطان الدم وفي البعض الآخر يصابون بأنواع مختلفة أو أنواع مختلفة من السرطانات المرتبطة بالدم. الأفراد الذين يعانون من شذوذات كروموسوميه لديهم نسبة أكبر بالإصابة بهذا السرطان. فعلى سبيل المثال، المُصابين بمتلازمة داون لديهم نسبة خطر أكبر للإصابة بسرطان الدم (خصوصاً سرطان الدم الحاد). كذلك وجود طفرة في جينspred1 له دور بالإصابة بسرطان الدم خلال الطفولة. يتمُّ دراسة قدرة الإشعاعات غير المؤيَّنة على التسبب في مرض ابيضاض الدم منذ عقود عديدة. أخذت مجموعة عمل أخصائيّي المنظمة العالمية لأبحاث السرطان على عاتقها البحث المُفصل في جميع البيانات حول حقول الطاقة الكهرومغناطيسية الساكنة وذات التردد المنخفض التي تظهر طبيعيا عند توليد ونقل واستخدام الطاقة الكهربائية، توصَّلوا إلى أنَّ هناك أدلَّة محدودة على أنَّ التعرض لكميات كبيرة من الموجات المغناطيسية منخفضة التردد قد تسبب بعض أنواع ابيضاض الدم لدى الأطفال ولم يتم إثبات أي علاقة مع سرطانات الدم الأخرى والأورام لدى الكبار . حيث أنَّ التعرض لمثل تلك الكميات (إذا تم إثباته كعامل مسبب) أمر غير شائع . توصلت منظمة الصحة العالمية أنَّ مثل تلك الإشعاعات تسبب 100-2400 حالة من ابيضاض الدم لدى الأطفال سنويَّاً ما نسبته 0.2 إلى 4.9% من حالات ابيضاض دم الأطفال في تلك السنة وما نسبته 0.03-0.9% من جميع حالات ابيضاض الدم تم تسجيل بعض حالات ابيضاض الدم لدى الأطفال نتيجة انتقاله من الأم إلى الجنين في حالة إصابة الأم بابيضاض الدم أثناء الحمل وفقاً للدراسة التي أجراها مركز البحث في الأوبئة والصحة السكانية في فرنسا، فإنَّ الأطفال الذين يُولدون للأمَّهات اللاتي يستخدمن أدوية الخصوبة لتحفيز الإباضة تكون فرصتهم في الإصابة بابيضاض الدم في فترة الطفولة مرتين أكثر من الأطفال الآخرين
هناك عدة عوامل يمكنها أنْ تجعل الشخص عرضةً للإصابة بابيضاض الدم أكثر من غيره وهي: التعرض للإشعاعات. حيث تم ملاحظة أنَّ العاملين في الأشعة من أطباء وفنيين والمرضى الذين تم علاجهم من مرض التهاب الفقار المُقَسِط (Ankylosing Spondylitis) باستخدام الأشعة مقارنة بالمرضى الذين استُخدمَت معهم علاجات غير العلاج بالأشعة والناجين من القنبلة الذرية في هيروشيما وناكازاكي في اليابان جميعهم أظهروا نسبةً أعلى للإصابة بابيضاض الدم.
التعرض لبعض المركبات الكيميائية مثل الكلورمفينيكول (Chloramphenicol) والبنزين وبعض المضادات الحشرية. وهناك بعض الأدوية التي تستخدم في علاج السرطانات مثل فينيل ألانين الخل الذي يستخدم في علاج الورم النِقَوي المتعدد وبعض المواد القاعدية التي تستخدم في علاج مرض هودجكين وبعض الأدوية المثبطة مناعيّاً.
بعض الأمراض الوراثية مثل متلازمة داون ومتلازمة بلووم.
بعض الفيروسات مثل Human T-Lymphocyte بنوعيه الأول HTLV-1 والثاني HTLV-2 وذلك عن طريق إدخال جين ورمي (Oncogene) لخلايا الإنسان مما يجعلها سرطانية.
التشخيص

زيادة خلايا الدم البيضاء في ابيضاض الدم (اللوكيميا)
يتم تشخيص المرض مخبرياً وذلك بإجراء عدة فحوصات ومن أهمها العد الكامل لمكونات الدم (Complete Blood Count CBC) ومن خلال هذا الفحص يمكن إعطاء إشارات أولية باحتمال الإصابة بأبيضاض الدم.
الفحص السريري للكشف عن وجود تضخم في الكبد أو الطحال أوالعقد اللمفاوية
خزعة من نخاع العظم وذلك بفحص تلك الخزعة تحت المجهر بعد صبغها ببعض الصبغات الخاصة التي تشير إلى وجود أبيضاض في الدم.
في بعض الأحيان فحوص الدم لا تظهر إصابه المريض بسرطان الدم خصوصاً خلال بداية المرض أو خلال كُمون المرض أي بدون أعراض. في بعض أنواع السرطان يمكن استخدام خزعة من العقد اللمفاوية. بعد التشخيص يمكن إجراء فحوص الدم الكيميائية لتحديد الضرر المُصيب للكلية والكبد وتأثير العلاج الكيميائي على المريض. ومن الممكن استخدام x-ray وهي صوره الأشعة السينيه أو ultrasound الأشعة فوق الصوتية أو التصوير بالأشعة المغناطيسية MRI. وهذه الفحوصات تستخدم لكشف ضرر بالعظام (السينيه) أو الدماغ (ام ار أي) أو الكلية أو الطحال أو الكبد (فوق الصوتية). يمكن استخدام التصوير المقطعي المحوسب (ال سي تي) لفحص العقد اللمفاوية بالصدر ولكن هذه الطريقة نادره الاستخدام. بالرغم من استخدام هذه الطرق لتشخيص المريض إذا كان مصاب أم معافى، إلَّا أنَّ من الناس لم يتم تشخيصهم وسبب ذلك هو التشخيص الخاطئ لتشابه الأعراض مع أمراض أخرى. ولهذه السبب تقدر جمعية السرطان الأمريكية أنَّه على الأقل خُمسةٌ من الأشخاص الذين يعانون من سرطان الدم لم يتم تشخيصهم بالمرض.
المعالجة
هناك عدة طرق مستخدمة لعلاج ابيضاض الدم. بناء على حالة المريض وحدَّة المرض ونوع المرض يتم اتخاذ العلاج المناسب. ومن أكثر العلاجات استخداما: العلاج الكيميائي (Chemotherapy): ويتم فيه إعطاء المريض أدوية مثل (hydroxyurea, busulfan, etoposide, glivec ,tasigna ,daunorubicin) وغيرها للقضاء على الخلايا السرطانية.
العلاج بالأشعة (Radiotherapy): تعريض المريض للأشعة للقضاء على الخلايا السرطانية.
زراعة نخاع العظم (Bone Marrow Transplantation)
العلاجات المساعدة نقل دم: وذلك لمعالجه فقر الدم وعلاج النزيف.
مضادَّات حيويه (Antibiotics) وإنترفيرون (Interferon): ليتم دعم الجسم مناعياً ويجعله مُقاوِماً للأمراض.
سرطان الدم الحاد الليمفاوي
البؤرة التدبيريَّة العلاجية هي السيطرة على نخاع العظم وعلى المرض في جميع أجهزة الجسم (لكلِّ الجسم). بالإضافة إلى أنَّ العلاج يمنع الخلايا السرطانية من الانتشار إلى مناطق أخرى بالجسم وتحديدا الجهاز العصبي المركزي، فعلى سبيل المثال إجراء خزعةٍ من النخاع الشوكي شهرياً. بشكل عام الخطة العلاجية لهذا المرض تقسم إلى عدَّة مراحل: المرحلة الاستهلاكية أو الحثية: وتهدف للوصول إلى حالة استقرار نخاع العظم والخطة عند البالغين أو الخطة الاستهلاكيَّة تتكون من الأدوية برويليزون. فبكريسين وانثراسيكلين، والطرق العلاجية الأخرى تتكون من سيكلوفوسفيد ول-سباراجينياس. أَمَّا في الأطفال ذوي الخطورة العالية نستخدم برينليزون ول-اسباراجينياس وفينكيسترين.
الخطة العلاجية المركزة المكثفة تهدف إلى حصر عدد الخلايا السرطانية المتبقية. ولها عدّة طرق وبشكل تقليدي هي جرعه عالية من عدة علاجات وتتم خلال عدَّة أشهر، أمَّا ذوي الخطورة المتوسطة والمنخفضة يُعطى مضاد الأيض مثل الميثوكريكسيات و6-مركابتوبورون، وفي الخطورة العالية يعطون جرعات عالية من نفس الأدوية السابقة بالإضافة لأدوية أُخرى.
حماية الجهاز العصبي المركزي وهي حماية وقائية تتمثل بالعلاج الإشعاعي وقد تعطى بعض العلاجات مباشره داخل النُّخاع الشوكي.
العلاج الكيمائي وذلك للوقاية من عدم رجوع المرض وعادة تتكون من جرعه منخفضة من عدَّة علاجات وتستمر لثلاث سنوات.
كبديل في حالة المرض ذي الخطورة العالية يمكن عمل زرع نخاع العظم.
السرطان اللمفاوي المزمن
قرار المعالجة
وتعتمد على مرحلة المرض والأعراض . أغلبيَّة مرضى سرطان الدم اللمفاوي المزمن والذين لديهم درجه منخفضة من المرض لا يستفيدون من العلاج، والذين لديهم مضاعفات čيستفيدون من العلاج . بشكل عام المؤشرات للعلاج هي: هبوط مستوى خضاب الدم أو الصفائح الدموية.
تطور مرحلة المرض لمرحلة أخرى
تضخم مؤلم بالغدد اللمفاوية أو الطحال
زيادة في إنتاج عدد كريات الدم اللمفاوية
النهج العلاجيسرطان كريات الدم المزمن غير قابل للشفاء بالعلاجات الحالية. خطه العلاج الكيماوي هي تشكيلة من كلورامبوسيل أو سيكلوفوفسفايد بالإضافة إلى الكلوجوستيدويدات مثل بريدنيولون أو بريدنون . إنَّ استخدام الستيرويد له إضافة علاجيَّة بإحباط بعض الأمراض المناعية مثل فقر الدم أو نقص الصفائح المناعية، في بعض الحالات المستعصية يعطى العلاج المركب مع أدوية النيكليوسيد كالفلودرابين
والبينتوستاتين أو كلادربين وقد يكون ناجحاً في الحالات الأصغر سنَّاً يمكن زرع نخاع العظم وزرع النسيج الذاتي أو غير الذاتي.
سرطان الدم النقوي الحادعدد مختلف من العلاجات المضادة للسرطان فعّآلة في علاجه، المعالجة تختلف حسب العمر وحسب النوع الفرعي للسرطان. بشكل عام استراتيجية السيطرة على المريض تتمثل بالسيطرة على نخاع العظم وأجهزة الجسم كلِّها وتوفير علاج خاص للجهاز العصبي عند إصابته. وبشكل عام أغلبية أخصَّائي الأورام يعتمدون على تركيبة العلاجات المتعددة للمعالجة الحثية الاستهلاكية مثل هذا النهج المتعدد الدوائي عادةً ما يوفر السكون المرضي وانخفاض في خطورة مقاومة المرض للعلاج، العلاج المكشف والصياني تُعطى للوقاية من رجوع المرض وتُعطَى بهذه المرحلة نفس الأدوية في مرحله الحث وأدوية أخرى . كما أَنَّ العلاج الصياني يُعطى بجرعات أقل من الحثي. أما في حاله السكون المرضي فإنَّ العلاج الصياني يكون بجرعات أقل من جرعات العلاج الحثي.
سرطان الدم النقوي المزمنهناك عدة احتمالات والشكل الرئيسي للعلاج عند المرض الحاد ويشمل بإعطائهم ايماتينيب هذا العلاج بالمقارنة مع العلاجات الأخرى له مميزات منها قلَّة الآثار الجانبية ويُعطى عن طريق الفم. وبهذا العلاج يكون أكثر من 90 بالمائة تحت السيطرة لمده خمس سنوات ولهذا يصبح مزمن يمكن علاجه. أمَّا في الحالات المتقدمة عند فقدان السيطرة أو عدم المريض للعلاج أو عند رغبة المريض بالشفاء كليَّاً من المرض يمكن استخدام عمليه زرع نخاع العظم من مصدر غير ذاتي. وهذه الزراعة قد يدخل ضمنها العلاج الشعاعي والكيمائي و30 بالمائة من المصابين يموتون بعد القيام بهذه العملية.
الخلايا الشعورية
عندما لا يوجد أعراض عند المريض فإنَّه لا يُعطى أيُّ علاج . بشكل عام يعطى علاج يعتبر ضروري عندما تظهر على المصاب علامات وأعراض كعدد خلايا الدم المنخفض (على سبيل المثال، معدل خلايا مكافحة العدوى أقل من 1.0 K / ميكرولتر) والالتهابات المتكررة والكدمات غير المبررة وفقر الدم أو التعب والتي هي كبيرة بما يكفي لتعطيل حياة المريض اليومية.
النهج العلاجي التقليدي إنَّ المريض الذي قد يحتاج معالجة سوف يتناول كلاديبن لأسبوع ويُعطى عن طريق الوريد أو جرعه تحت الجلد أو يمكن أن يتناول بيتوستاتين لمدة أربعه أسابيع . وفي كثير من الحالات دورة واحدة من العلاج ينتج عنها توقُّف للمرض لفترة طويلة.هناك علاجات أخرى تُعطى مثل ريتوكسياب من خلال الوريد مع انترفيرون ألفا، أو في حالات محدودة يمكن للمريض الاستفادة من إزالة الطحال، مثل هذه العلاجات لا تُعطى منذ البداية لأنَّ احتمال نجاحها أقل من الكلدريبين أو البينتوستاتين.
ابيضاض الدم T-prolymphocyticمعظم المرضى المصابين ب ابيضاض الدم t-cell prolymphcytic (وهو نوع نادر جداً وعنيف، متوسط الحياة يقل عن السنة الواحدة) يتطلبون علاجاً فورياً .هذا النوع من ابيضاض الدم صعب العلاج ولا يستجيب لمعظم العلاجات الكيماوية المتوافرة. تم تجربة علاجات مختلفة ولاقت نتائج محدودة في مرضى معينين مثل: أشباه البيورين (pentostatin, fludarabine, cladribine)، chlorambucil، وتوليفات متنوِّعة من العلاجات الكيماوية (cyclophosphamide, doxorubicin, vincristine, prednisone CHOP, cyclophosphamide, vincristine, prednisone [COP], vincristine, doxorubicin, prednisone, etoposide, cyclophosphamide, bleomycin VAPEC-B). Alemtuzumab مضاد أحادي النسيلة يهاجم خلايا الدم البيضاء تم استخدامه كنوع من العلاج ولاقى نجاح أكبر من الخيارات السابقة. بعض المرضى الذين يستجيبون للعلاج يخضعون أيضاً لزراعة الخلايا الجذعية لتدعيم استجابتهم للعلاج.
سرطان ابْيِضاضٌ وَحيدِيٌّ نِقَوِيّ اليَفَعِيّ (Juvenile myelomonocytic)علاج هذا النوع من السرطان يمكن أن يكون باستئصال الطحال والعلاج الكيميائي، وزراعة نخاع العظم.
علم الأوبئة

حسب السن نسب الوفيات جراء ابيضاض الدم لكل 100,000 نسمة في عام 2004.
في عام 2010 تُوفِّي حوالي 281,500 شخص بابيضاض الدم حول العالم. وفي عام 2000 طوَّر حوالي 256,000 طفل وبالغ شكلاً من أشكال اللوكيميا حول العالم، وتوفي منهم 209,000 . يمثل هذا حوالي 3% من سبعة ملايين حالة وفاة بسبب السرطان في ذلك العام وحوالي 0.35% من إجمالي الوفيات لأسباب مختلفة. من المواقع الـستّة عشرة المنفصلة التي تم مقارنتها كان مرض ابيضاض الدم في المرتبة الثانية عشرة في تصنيف الأمراض الأكثر شيوعاً والحادي عشر من حيث الوفيات لأسباب تتعلق بالسرطان.
الولايات المتحدةتتأثر حوالي 245,000 شخص في الولايات المتحدة ببعضٍ من أشكال سرطان الدم بما في ذلك تلك التي حققت علاج. وزادت المعدلات 1975-2011 بنسبة 0.7٪ سنويَّاً بين الأطفال. تم تشخيص ما يقرب من 44270 حالة جديدة من سرطان الدم في عام 2008 في الولايات المتحدة. وهذا يُمثِّل 2.9٪ من جميع حالات السرطان (باستثناء الخلايا القاعدية بسيطة والجلد الحرشفية الخلايا السرطان) في الولايات المتحدة، و30.4٪ من جميع سرطانات الدم.من بين مجموع الأطفال الذين يعانون من أي شكل من أشكال السرطان، حوالي الثلث يعانون من سرطان الدم، الأكثر شيوعاً من هذه الأنواع سرطان الدم الليمفاوي الحاد. وهناك نوع من سرطان الدم هو الشكل الثاني الأكثر شيوعا من بين أنواع السرطان في الأطفال (دون سن 12 شهرا) والشكل الأكثر شيوعا من بين أنواع السرطان في الأطفال الأكبر سنا. البنين إلى حدٍّ ما أكثر عرضة للإصابة بسرطان الدم من الفتيات، والأطفال الأميركيين البيض لديهم ضعف احتماليَّة الإصابة بسرطان الدم للأطفال الأمريكيين السود. فقط حوالي ٪3 من حالات السرطان المُشخَّصة عند البالغين تكون للوكيميا، ولكن لأنَّ السرطان أكثر شيوعا بين البالغين يتم تشخيص أكثر من 90% من سرطانات الدم عند البالغين.أصول الأفراد هو أحد عوامل الخطر في الولايات المتحدة؛ اللاتينيين وخاصة من هم دون سن ال 20 هم الأكثر عرضة لسرطان الدم. في حين البيض الأميركيين الأصليين والأميركيين الآسيويين وسكان ألاسكا الأصليين هم أكثر عرضة من الأميركيين الأفارقة.الجنس هو أيضاً أحد عوامل الخطر؛ الرجال هم الأكثر إصابة بالمرض ويموتون بسببه بنسبة أكبر من النساء. حوالي 30 في المائة الرجال أكثر من النساء بنسبة الإصابة بسرطان الدم. سرطان الدم أكثر شيوعا في الدول المتقدمة.
المملكة المتحدةعموماً سرطان الدم هو الحادي عشر من أكثر أنواع السرطان شيوعا في المملكة المتحدة (تم تشخيص حوالي 8600 شخص يعانون من هذا المرض في عام 2011) وهو السبب التاسع من الأسباب الأكثر شيوعا لوفيات السرطان (توفي حوالي 4800 شخص في عام 2012).
التاريخرودولف فيرشو وُصف ابيضاض الدم للمرة الأولى على يد المُشرّح والجرّاح الفرنسي ألفرد-أرمند-لويس-ماري-فيلبو عام 1827. أعطى اختصاصي الباثولوجيا رودولف فيرشو وصفًا أكثر شمولية عام 1845. بعد أن رأى فيرشو عدد كبير بشكل غير طبيعي لخلايا الدم البيضاء في عينة من دم المريض . أطلق فيرشو على الحالة اسم لوكيميا (Leukämie) باللغة الألمانية، والتي تتشكل من الكلمتين اليونانيتين لويكوس (leukos; λευκός)، والتي تعني «أبيض»، وهيما (haima; αἷμα)، والتي تعني «دم». بعد نحو عشر سنوات من نتائج فيرشو، وجد اختصاصي الباثولوجيا الألماني فرانتس إرنست كريستيان نومان أنَّ نخاع العظم في متوفي مريض ابيضاض الدم كان ذو لون «أخضر-أصفر قذر» بدلاً من اللون الأحمر العادي. استنتج نومان من هنا أنَّ مشكلة في نخاع العظم هي المسؤولة عن الدم غير الطبيعي في مرضى ابيضاض الدم. بحلول القرن العشرين اعتُبر ابيضاض الدم كمجموعة من الأمراض بدلًا من مرض واحد. وبحلول عام 1947 اعتقد اختصاصي الباثولوجيا من بوستون «سيدني فاربر» من تجارب سابقة أنَّ الأمينوبتيرين، وهو تقليد لحمض الفوليك، قد يشفي ابيضاض الدم في الأطفال. وقد أظهر معظم الأطفال مُصابي ابيضاض الدم اللمفاوي الحاد الذين فُحصوا علامات تحسُّن في نخاع العظم، ولكن لم يُشفى أيًا منهم في الواقع. ومع ذلك أدَّى ذلك إلى مزيد من التجارب. في عام 1962، استخدم الباحثَين إميل ج. فريريخ جونيور وإميل فري الثالث العلاج الكيميائي في محاولة لعلاج ابيضاض الدم. نجحت التجارب مع بعض المرضى الذين بقُوا على قيد الحياة فترة طويلة بعد التجربة.
المجتمع والثقافةوفقا لسوزان سونتاغ: إنَّ لسرطان الدم طابعاً رومانسياً في القرن العشرين، صُّور على أنه ينهي الفرح، المصابين هم ضحايا أبرياء ماتوا صغاراً أو في الوقت غير المناسب. على هذا النحو وكانت الخليفة الثقافية له هو مرض السل، الذي حمل هذا اللقب الثقافي حتى اكتشف أنه أحد الأمراض المعدية.
الرواية الرومانسية (قصة حب) هي مثال على تفسير الرومانسية في سرطان الدم.
في الولايات المتحدة أُنفق حوالي 54 بليون دولار على العلاج في السنة.
اتجاهات البحوثيتم تنفيذ بحوث مهمة في الأسباب والانتشار والتشخيص والعلاج والتشخيص لسرطان الدم. ويجري التخطيط لمئات من التجارب السّريرية له
وتركز الدراسات على وسيلة فعّآلة للعلاج وأفضل الطرق لعلاج هذا المرض وتحسين نوعية الحياة للمرضى أو الرعاية المناسبة خلال أو بعد العلاج.
بشكل عام هناك نوعان من بحوث سرطان الدم: البحوث السريرية أو التفسيرية والبحوث الأساسية. وتركز البحوث السريرية / البحوث التفسيرية على دراسة هذا المرض بطريقة محددة وغير محدده بطرق تناسب المريض؛ مثل اختبار دواء جديد في المرضى. على النقيض من ذلك تدرس البحوث العلمية الأساسية المرض بأبعاد أخرى؛ مثل رؤية ما إذا كانت مادة مُسرطنة يمكن أن تسبِّب تغيرات اللوكيميا في الخلايا المعزولة في المختبر أو كيف يتغير DNA داخل خلايا سرطان الدم. النتائج من الدراسات البحثية الأساسية عادة ما تكون أقل إفاده للمرضى الذين يعانون من هذا المرض.ويجري حالياً متابعة العلاج عن طريق العلاج الجيني. وإحدى هذه الطرق تستعمل خلية تائية (T cell) لمهاجمة الخلية السرطانية. في عام 2011 بعد عام من إجراء العلاج اثنين من ثلاثة مرضى شفوا من سرطان الدم الليمفاوي المزمن وفي عام 2013 ثلاثة من خمسة اشخاص الذين عانوا من سرطان الدم الليمفاوي الحاد أصبح لديهم حالة من الخمود لمدة خمسة أشهر أو عامين يجري حالياً تحديد الخلايا الجذعية التي تسبب أنواع مختلفة من سرطان الدم.
الحملنادراً ما يرتبط سرطان الدم مع الحمل. يؤثر فقط في حوالي 1 من 10.000من النساء الحوامل. طريقة التعامل مع المرض تعتمد بالدرجة الأولى على نوع سرطان الدم. تقريباً جميع سرطانات الدم التي تظهر عند النساء الحوامل هي سرطانات الدم الحادة. اللوكيميا الحادة تتطلب عادة علاج عدواني سريع. على الرغم من المخاطر الكبيرة لفقدان الحمل والتشوهات الخلقية وخاصة إذا تم إعطاء العلاج الكيميائي أثناء الأشهر الثلاثة الأولى والتي هي حساسة لحالة الطفل التنموية.ويمكن علاج سرطان ابيضاض الدم النقوي المزمن في أي وقت خلال فترة الحمل باستخدام الهرمونات إنترفيرون ألفا. علاج اللوكيميا اللمفاوية المزمنة والذي هو نادر عند النساء الحوامل يمكن تأجيله إلى ما بعد نهاية الحمل.
الأبحاثوجدت مجموعة بحث أن لمركب سكلاريول القدرة على إحداث أثر الاستماتة على بعض أنواع خلايا مرض ابيضاض الدم.
انظر أيضاًسرطان الدم الليمفاوي الحاد
سرطان الدم النقوي الحاد
سرطان الدم الليمفاوي المزمن
سرطانة خلايا الدم
أمراض الدم
سرطان الغدد الليمفاوية
ألفرد فرانسوا دونيه
جون هيوز بينيت
========
لوكيميا الأرومة اللمفاوية الحادة{{{من ويكيبيديا، الموسوعة الحرة
لوكيميا الأرومة اللمفاوية الحادة

نضح العظم تشويه من شخص مع السلائف B- الخلية ALL. الخلايا الأرجواني الكبيرة هي الأورام اللمفاوية.
معلومات عامة
الاختصاص علم الأورام
من أنواع لوكيميا حادة، ومرض
المظهر السريري
الأعراض حمى و، وضعف، وإعياء، وفقدان الوزن، وفقدان الشهية، وآلام العظم، وألم البطن، وضيق النفس
أدوية{{تينيبوسيد
لوكيميا الأرومة اللمفاوية الحادة أو ابيضاض الدم الليمفاوي الحاد (بالإنجليزية: Acute Lymphocytic Leukemia) هو مرض سرطاني يحدث بسبب تكاثر غير طبيعي للخلايا الأرومية الليمفاوية في نخاع العظم.
يتم تشخيص 4000 حالة سنويا في الولايات المتحدة وبمعدل إصابة 1.4/100000 شخص. يصيب البالغين وخاصة من عمر الخمسين فما فوق، ويعد من أكثر السرطانات شيوعا في مرحلة الطفولة وخاصة ما بين الأطفال من 3-7 سنوات حيث يشكل ما نسبته 30% من الأمراض السرطانية التي تصيب الأطفال.
يعد أبيضاض الدم الليمفاوي الحاد الذي يصيب الخلية الليمفاوية من نوع B الأكثر شيوعا ونسبة الأصابة به ما بين الذكور والإناث متساوية، على عكس المرض الذي يصيب الخلية الليمفاوية من نوع T حيث تظهر الإحصاءات نسبة اصابة أعلى في الذكور من الإناث 1.3: 1.0.
سبب الإصابة{{ أبيضاض الدم؛ مسببات المرض
لا يعرف ماهو المسبب الرئيسي للمرض إلا أن الإشعاعات الناتجة من القنبلة الذرية وبعض المركبات الكيميائية مثل البنزين يكون لها دور في التسبب بالمرض.
الأعراض
تظهر الأعراض تدريجيا على المريض وقد تأخذ أسابيع إلى عدة أشهر وقد تظهر بشكل مفاجئ وحاد. تكون الأعراض بشكل عام: شحوب وضيق في النفس وبعض التوعكات وذلك بسبب فقر الدم الحاصل.
ارتفاع حرارة المريض وذلك بسبب تكاثر الخلايا السرطانية.
آلام في المفاصل والعظام بسبب تسلل الخلايا السرطانية للسمحاق وتآكل العظم. مما يسبب اضطرابات في المشي وخاصة عند الأطفال مما يجعلهم رافضين للمشي على الأقدام
كدمات ونزيف تحت الجلد ونزيف من اللثة نتيجة نقص الصفائح الدموية.
تضخم في الكبد والطحال والغدد الليمفاوية.
يظهر ما نسبته 2% من حالات الإصابة بالمرض عند الأطفال وجود الخلايا السرطانية في سائل النخاع الشوكي مما يسبب صداع وتقيأ. وما نسبته 10% عند البالغين.
وجود بعض الأورام في منطقة الصدر وخاصة عند البالغين المصابين بالمرض من نوع السلسلة T.
الرغبة الملحة في النوم للشعور بالإرهاق الشديد.
عدم وجود رغبة لتناول الطعام أو الشراب.
التصنيف
تم تصنيف المرض بالاعتماد على شكل الخلايا السرطانية أو النمط الظاهري المناعي بواسطة مجموعة من العلماء الفرنسيين والأميركيين والبريطانيين (فاب) إلى: تصنيف حسب شكل الخلايا السرطانية: L1 وتكون الخلايا الأرومية موحدة الشكل وصغيرة وتتميز أيضا بقلة ومحدودية سائل السايتوبلازم.L2 وتكون الخلايا الأرومية أكبر من النوع السابق ومتغير وكذلك وجود نوية ويكون سائل السيتولازم أكثر تعقيدا لاحتوائه على بعض العضيات.L3 خلايا أرومية أكبر من الأنواع السابقة مع نوية أكثر بروز ونضج من النوية السابقة وسائل سايتوبلازمي شديد القاعدية ووجود بعض الفجوات فيه. النمط الظاهري المناعي:
و يتم تقسيم المرض إلى نوعين وذلك بحسب عناقيد التمايز (Clusters of Differentiation) الموجودة على الخلايا الآرومية أبيضاض دم ليمفاوي حاد من نوع B وتصل نسبتها إلى 78% من الحالات.
أبيضاض دم ليمفاوي حاد من نوع T تشكل 22% من حالات الإصابة.
الإمراض الجزيئي
وجد العديد من الاضطرابات والاعتلالات الجزيئية في مرضى أبيضاض الدم الليمفاوي الحاد من أهمها: الاتحاد الجيني ما بين المورثة ABL والمورثة BCR (أو كما يعرف بكروموسوم فيلادلفيا) الناتج من الانتقال المكاني بين الكروموسومين 9 و 22 (t(9;22)q(34;q11 مما يؤدي إلى عمليات نقل إشارة لبروتينات لها دور في نمو الخلايا. 20-30% من حالات الإصابة عند البالغين، بينما لا تتعدى أكثر من 3% في حالات الإصابة عند الأطفال.
حدوث طفرات جينية في عدد من العوامل الناسخة التي لها دور رئيسي في عملية تكوين الدم. مثل عملية الانتقال المكاني بين الكروموسومين 12 و 21 (t(12;21)q(13;q22 مما ينتج تجاور للمورثتين AML1 و TEL.
حدوث اضطرابات في المورثات المثبطة للأورام مثل حذف أجزاء من المورثتين (p16(INK4A و(p15(INK4B
مآل المرض
هناك عدة عوامل ممكن أن تحدد مآل المرض كما يبينها الجدول.
العوامل المحددة لسير المرض
العامل جيد سيئ
عدد كريات الدم البيض منخفض مرتفع
الجنس إناث ذكور
النمط الظاهري المناعي B T
العمر طفل بالغ
الوراثة الخلوية صورة طبيعية أو TEL كروموسوم فيلادلفيا
مدة إزالة الخلايا الأرومية من الدم أقل من إسبوع أكثر من إسبوع
مدة تهدئة المرض أقل من 4 أسابيع أكثر من 4 أسابيع
وجود أعراض إصابة الجهاز العصبي المركزي غير موجودة موجودة
الحد الأدنى من بقايا المرض غير موجودة من فترة 1-3 شهور موجودة بعد 3-6 شهور
التشخيص المخبريعد كامل لمكونات الدم (Complete Blood Count) وقد يظهر هذا الفحص زيادة في أعداد كريات الدم البيضاء وفي بعض الحالات تكون ضمن العدد الطبيعي. ويظهر الفحص أيضا هبوط في مستوى الهيموكلوبين والصفائح.
أخد خزعة من نخاع العظم لدراسته نسيجيا. معظم الحالات تظهر وجود أعداد كبيرة من الخلايا الآرومية (ما لا يقل عن 90% من الخلايا).
التهجين الموضعي المتألق وذلك لدراسة الخلايا السرطانية وملاحظة وجود أية اختلالات وراثية (انتقالات مكانية أو حذف لأجزاء من الكروموسومات). معرفة نوع الاضطراب الخلوي قد يساعد الطبيب على توقع مسار المرض.
النمط الظاهري المناعي: وذلك بدراسة عناقيد التمايز الموجودة على الخلايا الأرومية وتحديد نوع المرض (B أو T) وهذا العامل أيضا له دور في تحديد مسار المرض.
العلاج
يتم علاج المرض بواسطة عدة طرق مثل العلاج الكيميائي والعلاج بالأشعة وزراعة نخاع العظم الخيفي واستخدام الأضداد وحيدة النسيلة (Monoclonal Antibodies) إلا أن العلاج الأخير ما زال تحت التجارب السريرية.
العلاج الكيميائي
تتم تقسيم عملية العلاج إلى عدة مراحل
1. تهدئة المرض: في هذه المرحلة الهدف الرئيسي من العلاج هي محاولة القضاء على الخلايا السرطانية والوصول إلى مرحلة التهدئة وتتمثل بعدم زيادة نسبة الخلايا الأرومية في نخاع العظم عن 5% وصورة طبيعية للدم المحيطي وعدم وجود أية أعراض للمرض. يتم علاج المريض بواسطة بردنيسلون (Prednislone) وديكساميثاسون (Dexamethasone) وفينكريستين (Vincristine) وأسبارجنيز (Asparginase). يتم الوصول إلى التهدئة في 90% من الحالات الإصابة بالمرض عند الأطفال و 80 - 90% من حالات الإصابة عند البالغين.
2. تكثيف العلاج: يتم دمج عدة أدوية مع بعضها وتعطى للمريض بهدف محاولة القضاء على المرض أو تقليل الخلايا السرطانية بشكل كبير إلى مستويات ضئيلة جدا. أدوية مثل فينكريستين (Vincristine) وسيكلوفوسفامايد (cyclophsphamide) وسايتوسين أرابينوسايد (Cytosine Arabinoside) وثايوكوانين (Thioguanine) وإيتوبوسايد (Etoposide) ومركابتوبيورين (Mercaptopurine) تعطى للمريض على شكل توليفات مختلفة حسب حالة المريض وقدرته على التحمل.
3. مداومة العلاج: وتستمر من 2-3 سنوات، يعطى المريض جرعة يومية عن طريق الفم من مركابتوبيورين (Mercaptopurine) وجرعة إسبوعية من ميثوتركسيت (Methotrexate). يتم تقليل العلاج تدريجيا عن التأكد من عدم وجود الحد الأدنى من بقايا المرض (Minimal Residual Disease).
في بعض الحالات التي يتم فيها انتشار الخلايا السرطانية في الجهاز العصبي المركزي يتم علاج المريض بواسطة ميثوتركسيت (Methotrexate) أو عن طريق التشعيع القحفي (Cranial Irradiation) إلا أنه بفضل عدم استخدام التشعيع القحفي مع المصابين من الأطفال.
طرق أخرى للعلاجزراعة نخاع العظم الخيفي في بعض الحالات التي لا تبدي أي تقدم أو تحسن عند استخدام العلاج الكيميائي. إلا أن لهذا العلاج يتوجب بعض الشروط مثل عمر المريض وحالته ووجود متبرع مناسب، وينطوي هذا العلاج على بعض المخاطر مثل عدم نجاح الزراعة مما يؤدي إلى تحفيز المريض مناعيا ومرض المريض ضد الطعم.
استخدام علاج إيمينتاب للمرضى المصابين بكروموسوم فيلادلفيا ويظهرون وجود الاتحاد الجيني BCR-ABL.
استخدام الأضداد وحيدة النسيلة. ويتم توجيه هذه الأضداد إلى الخلايا السرطانية بحسب عناقيد التمايز التي تظهرها. أظهرت الأبحاث أن استخدام روتكسيماب (Rituximab) -موجه ضد عنقود التمايز 20- وكامباث 1 (Campath-1) - موجه ضد عنقود التمايز 52 - مع العلاج الكيميائي يعطي نتائج جيدة. بعض الأدوية لعناقيد تمايز أخرى ما زالت تحت التجارب السريرية
معرض صور



======
بيضاض الدم الليمفاوي المزمن{{من ويكيبيديا، الموسوعة الحرة
ابيضاض الدم الليمفاوي المزمن

مسحة الدم المحيطي تظهر خلايا CLL
معلومات عامة
الاختصاص علم الدم
من أنواع ابيضاض الدم المزمن، ولمفوما، وابيضاض الدم،
ابيضاض الدَّم أو اللوكيميا (بالإنجليزية: Leukemia) هو عبارة عن مرض خبيث للجملة المكونة للدم ويتصف بزيادة عدد الكريات البيضاء غير النَّاضجة في الدَّم ونقي العظم. في دراسة أجرتها مجموعة الشرق الأوسط لأبحاث السرطان أظهرت إصابة 515 شخص في مصر ما بين العامين 1999-2001 و1354 شخص في الأردن بابيضاض الدم ما بين عامي 1996-2001. ويسمَّى أيضاً باللوكيميا أو سرطان الدم يبدأ هذا المرض في نخاع العظام وينتشر إلى الأجزاء الأخرى من الجسم.سرطان الدم هو مجموعة من الأورام الخبيثة التي تبدأ عادة في نخاع العظم وتتميز بعدد مرتفع من خلايا الدم البيضاء غير الطبيعية. وهذه الخلايا الناتجة تكون غير ناضجة تماماً وتسمى الأورمة. والأعراض هي نزيف، رضَّات (تكدُّمات)، الشعور بالتعب، ارتفاع درجة الحرارة وزيادة خطر الإصابة بالالتهابات. هذه الأعراض هي نتيجة نقص خلايا الدَّم الطبيعية ويتم التشخيص عن طريق فحوص الدم أو خزعة من نسيج العظم. سبب سرطان الدَّم غير معروف ويختلف السَّبب باختلاف نوع سرطان الدم. تلعب العوامل الوراثية والظروف البيئية دوراً في الإصابة بسرطان الدم. العوامل التي تزيد فرصة حدوث سرطان الدم هي التدخين والإشعاع الأيوني وبعض المواد الكيميائية مثل حلقة البنزين أو في حال الخضوع لعلاج كيميائي مسبق ومتلازمة داون. كما أنَّ الأشخاص الذين لديهم تاريخ عائلي بمرض سرطان الدم تزداد نسبة إصابتهم. يوجد أربعة أنواع رئيسية لسرطان الدم وهي سرطان الدم الليمفاوي المزمن، سرطان الدم النخاعي الحاد، سرطان الدم الليمفاوي الحاد، سرطان الدم النخاعي المزمن وهنالكَ أنواع أخرى ولكن غير شائعة. سرطان الدم وسرطان الغدد الليمفاوية يندرجان تحت نوع السرطان الذي يؤثر على الدم ونخاع العظم ونظام الغدد الليمفاوية وتسمى بأورام مكونات الدم والأنسجة الليمفاوية. علاج سرطان الدم يتضمَّن مزيج من العلاج الكيميائي والإشعاعي والعلاج المُستهدف وزرع نخاع العظم والرعاية المساندة والمسكنة للآلام. بعض أنواع سرطان الدم الانتظار اليقظ. نجاح العلاج يعتمد على نوع سرطان الدم وعمر المصاب. نتائج العلاج متطورة في البلدان المتقدمة. معدل عيش المصابين لمدة 5-سنوات هو 57% بالولايات المتحدة. الأطفال الذينَ يقلُّ عمرهم عن 15 سنة معدل النجاة لمدة 5-سنوات يقاس 60-85% بالاعتماد على نوع السرطان. إنَّ الأطفال الذين أُصيبوا بسرطان الدم الحاد ثم تعالجوا وبقوا أصحَّاء لمدة 5-سنوات هم في الأغلب لن يعانوا من عودة السرطان مرة أخرى. عام 2012 ,352 ألف شخص أُصيبوا بسرطان الدم حول العالم وأدَّى ذلك إلى وفاة 265 ألف حالة. يعتبر سرطان الدم هو الأكثر شيوعاً بين الأطفال، ثلاثة أرباع الأطفال المصابينَ مصابينَ بنوع سرطان الدم الحاد. ومع ذلك، فإنَّ 90% من سرطان الدم يتم تشخيصه بالبالغينَ وغالباً يكون النوع سرطان الدم المزمن أو سرطان الغدد الليمفاوية الحاد. وأعلى نسب تكون في البلدان المتقدمة.
التصنيف
التصنيف العام
أنواع سرطان الدم \ تصنيفاتهم:
أربعة أنواع رئيسية لابيضاض الدم نوع الخلية حاد مزمن
ابيضاض دم لمفاوي
(أو "ابيضاض الأرومات اللمفاوية") ابيضاض الدم الليمفاوي الحاد
(ALL) ابيضاض الدم الليمفاوي المزمن (CLL)
ابيضاض الدم النقوي الحاد
(AML أو الأرومات النقوية) ابيضاض الدم النقوي المزمن
(CML) ابيضاض دم نقوي
("نخاعي" أو "غير لمفاوي")
سرطان الدم يُصنَّفُ سريريَّاً ومرضيَّاً إلى عدة أنواع وأوًل نوع يتضمَّن حدة المرض (حاد، مزمن): السرطان الحاد يتصف بزيادة في عدد خلايا الدم غير الناضجة ممَّا يجعل نخاع العظم مزدحم بهذه الخلايا فتقل قدرته على إنتاج خلايا طبيعية. سرطان الدم الحاد يتطلب علاج فوري بسبب التطور السريع وتجمع الخلايا السرطانية التي تخرج من الدم وتنتشر إلى أعضاء أخرى. إنَّ سرطان الدم الحاد هو الأكثر شيوعا بين الأطفال.
السرطان المزمن يتصف بوجود عدد كبير من الخلايا البيضاء الناضجة نسبياً ولكنها تمتلك شكلا غير طبيعي. خلايا الدم البيضاء في العادة تحتاج إلى شهور أو سنوات لتنضج ولكن في هذه الحالة خلايا الدم البيضاء تنتج بسرعة عالية مما يؤدي إلى وجود عدد كبير من خلايا البيضاء غير الطبيعية. يستلزم سرطان الدم الحاد معالجة فورية، بينما سرطان الدم المزمن يستلزم مراقبة لفترة معينة قبل تطبيق العلاج وذلك لضمان التأثير الأكبر الممكن للمعالجة. سرطان الدم المزمن عادةً يصيب كبار السن ومن الممكن أنْ يحصل أيضاً ضمن أيِّ فئة عمرية.
بالإضافة إلى أنَّه يمكن تقسيم سرطان الدم حسب نوع خلية الدم المتأثرة، فيتم تقسيم سرطان الدم إلى سرطان الأنسجة الليمفاوية وسرطان نخاع العظم. في سرطان الأنسجة الليمفاوية، التغيُّر السرطاني يحدث في نوع من خلايا النخاع العظمي والتي عادةً ما تتحول أو تُكوِّن خلايا الليمف والتي تُعد خلايا مناعية تهاجم المرض؛ أغلب سرطانات الأنسجة الليمفاوية تحتوي على نوع بيتا من خلايا الليمف.
في سرطان نخاع الدم، يحدث التغير السرطاني في خلايا نخاع العظم التي تُكوِّن عادة خلايا الدم الحمراء، وبعض أنواع خلايا الدم البيضاء والصفائح الدموية.
الجمع بين هذين التصنيفين يوفِّر أربع فئات رئيسية. داخل كل فئة من هذه الفئات الرئيسية هناك عادةً عدَّة فئات فرعية. وأخيراً، تُعتبر بعض الأنواع نادرةً وعادةً ما تكون خارج نظام هذا التصنيف.
أنواع خاصة
ابيضاض الدم الليمفاوي الحاد (ALL) هي أكثر الأنواع شيوعاً في الأطفال، كما أنَّه يصيب البالغين خصوصاً الذين تزيد أعمارهم عن 65 سنة. العلاج يتضمَّن علاج كيميائي وإشعاعي. معدل النَّجاة يختلف حسب عمر المريض 85% عند الأطفال و50% عند البالغين.
فروع هذا النوع هي سرطان النسيج اللمفاوي الحاد لخلايا B ، سرطان النسيج اللمفاوي الحاد لخلاياT، سرطان البيركت، سرطان الدم الحاد الذي له تمثيلان شكليان.
ابيضاض الدم الليمفاوي المزمن (CLL) والذي غالباً ما يصيب البالغين فوق جيل 55. وغالباً ما يصيب البالغين ولا يصيب الأطفال، وثلثي الأشخاص المصابين هم من الذكور. معدل النجاة لمدة 5 سنوات هو 75%.
السرطان المزمن غير قابل للشفاء، ولكنْ هنالكَ العديد من العلاجات الفعَّآلة. ولسرطان الدم المزمن يوجد تصنيف فرعي واحد وهو ابيضاض خلايا السليفة الليمفاوية ب والذي يعتبر مرض أكثر عدوانية.
ابيضاض الدم النقوي الحاد (AML) عادةً يصيب البالغين أكثر من الأطفال كما أنَّه يصيب الذكور أكثر من الإناث. يمكن علاجه بالعلاج الكيميائي. معدل النجاة لمدة 5 سنوات هي 40% ما عدا سرطان الدم الحاد البرولمفوسين الذي يمثل نسبة 90%.
فروع ابيضاض الدم النقويّ الحاد هي سرطان الدم البرولمفوسايت الحاد، سرطان الدم الميوبلاستي الحاد الذي يؤثر على الخلايا العضلية الجذعية وmegakaryoblastic leukemia.
ابيضاض الدم النقوي المزمن (CML) يحدث غالباً في البالغين ويصيب عدد قليل جدا من الأطفال. يتم علاجه بدواء Lmatnib أو أدوية أخرى. معدل النجاة لخمس سنوات 90%.
وله فرع واحد هو Chomic myelommocytic leukemia.
سرطان الدم الزغبي (سرطان الدم بالخلايا المشعرة)Hairy cell leukemia)HCL) هو نوع من أنواع سرطان الخلايا الليمفية المزمن، ولكنَّه لا يتناسب تماماً مع هذه الفئة. 80% من المصابين هم ذكور بالغين.لم يُذكر أنَّه تمَّ تسجيل أيِّ حالة في الأطفال.يوجد علاجات له لكن لا يمكن الشفاء منه. معدل النجاة من 96 إلى 100% خلالَ عشر سنوات.(T-PLL) (Tcell prolymphocytic leukemia) هو مرضٌ نادرٌ جدَّاً وخطير ويؤثر على البالغين وغالباً تأثيره على الذكور أكثر من الإناث. بالرغم من نُدرته، إلّا أنَّه الأكثر شيوعا من سرطانات الدم التي تُصيب خلايا ال Tcell,
أغلب أنواع سرطانات الدم تؤثر على ال Bcel. يصعب علاجه ومعدل النجاة يقاس بالأشهر فقط.
سرطان الدم الليمفي الذي يصيب الحبيبات الكبيرة وهي إمَّا تحوي Tcell أو NKcells، هو مرض نادر مثل سرطان الدم الزغبي، والذي يحدث فقط في الخلايا B وهو غير عدواني.سرطان الدم الي يصيب خلايا T البالغة. هو ناتج عن فيروس يسمى بالفيروس البشري الذي يصيب Tcell (HTLV) وهو فيروس شبيه بل HIV؛ حيثُ كلاهما يصيب خلايا CD4+ Tcell ويتضاعف فيها. على أيَّة حالٍ، هو يختلف عن فيروس HIV في كونه لا يدمِّر هذه الخلايا. بدلاً من ذلك، HTLV «يُخلِّد» خلايا T المصابة، مما يتيح لهم القدرة على التكاثر بشكل غير طبيعي. فيروس خلية T البشرية النوعين الأول والثاني منه (HTLV-I / II) مُستوطنة في مناطق مُحددة في العالم.
الأعراض والعلامات

أعراض شائعة لابيضاض الدم المزمن أو الحاد
في سرطان الدم يتم استبدال خلايا نخاع العظم الطبيعية بأعدادٍ كبيرة من خلايا الدم البيضاء غير النَّاضجة ممَّا يُؤدِّي إلى تحطيم نخاع العظم ونتيجة لذلك يقل عدد الصفائح الدموية التي تساعد في الوضع الطبيعي في عملية تجلُّط الدم. مما يعني أنَّ الأشخاص المصابين يصابون بكدمات بسهولة ويعانون من النزيف الزائد ويتكون لديهم نزيف على سطح الجلد أو ما يُسمَّى بالنمشات. خلايا الدم البيضاء (المسؤولة عن محاربة الكائنات الممرضة). سيقل عددها أو ستخسر وظيفتها الطبيعية. مما يؤدي إلى ضعفٍ بالجهاز المناعي فيصبح غير قادر على مواجهة الالتهابات البسيطة أو يبدأ بمحاربة خلايا الجسم الأخرى. يعاني مصاب سرطان الدم من الاتهابات المتكررة بسبب ضعف جهاز المناعة وهذه الالتهابات تتراوح بين التهاب اللوزين أو قرحة بالفم أو الإسهال إلى الالتهاب الرئوي أو الالتهابات بالكائنات الانتهازية. كما أنَّ عدد خلايا الدم الحمراء يقل مما يؤدي إلى فقر الدم والتي بدورها تسبب الشحوب وقصر النفس. بعض المصابين يعانون من أعراض أخرى مثل الشعور بالمرض، ارتفاع درجة الحرارة، التعرُّق خلال الليل، الشعور بالإرهاق وأعراض أُخرى تُشابه الأعراض المُصاحبة للإنفونزا. كما من الممكن أن يشعر الشخص بالغثيان والامتلاء بسبب تضخم الكبد والطحال مما يؤدي إلى نقص الوزن غير المقصود. الخلايا غير النَّاضجة قد تتجمع وتشكل انتفاخ بالكبد أو العقد الليمفية ممَّا يؤدِّي إلى الشعور بالألم وتؤدي إلى الشعور بالغثيان.
إذا اجتاحت الخلايا السرطانية الجهاز العصبي المركزي ستظهر أعراض وعلامات عصبية أهمّها الصداع. ومن الأعراض الأخرى: الصداع النصفي والتشنجات العصبية كما أنَّ ارتفاع الضغط على جذع الدماغ يؤدي إلى حدوث حالات الإغماء. يُذكر أنَّ جميع هذه الأعراض قد ترتبط بأمراض أخرى ولهذا سرطان الدم يتم تشخيصه عن طريق فحوص طبية. كلمة سرطان الدم (تعني ابيضاض الدم) مشتقة من وجود أعداد كبيرة من خلايا الدم البيضاء. تظهر هذه الأعداد عند فحص عينة من الدم باستخدام المجهر. وتكون هذه الخلايا الزائدة ذات أشكال غير طبيعية أو وظيفة غير طبيعية. كما أنَّ وجود عدد كبير من خلايا الدم البيضاء يؤثِّر على أعداد خلايا الدم الأُخرى مما يؤدي إلى اختلال في توازن كمية الدم.
بعض المصابين بسرطان الدم لا يكون عندهم ارتفاع في خلايا الدم البيضاء عند إجراء فحص تعداد الدم وهذه الحالة تسمى ندرة الكريات البيض (aleukemia) وفي هذه الحالة يحتوي نخاع العظم على خلايا دم بيضاء سرطانية تعمل على تدمير الخلايا الطبيعية المسؤولة عن إنتاج خلايا الدم ، أما الخلايا السرطانية نفسها تبقى في نخاع العظم بدلاً من الخروج إلى الدم. من الممكن أن يحدث ندرة الكريات البيض في الأربع أنواع السابقة من سرطان الدم ولكن الأكثر شيوعاً هو مُصاحباً لسرطان الدمي الزغبي.
إن امتلاء نخاع العظم بالخلايا السرطانية يثبط عملية بناء خلايا دم طبيعية مما يؤدي إلى نقص في كريات الدم الحمراء (أنيميا) وقصٍ في الصفائح الدموية، والتي تلعب دوراً أساسيَّاً في عملية تخثر الدم. من هنا، قد يعاني مرضى ابيضاض الدم من النزيف الذي غالبًا ما يحدث في اللثة، أو سطح الجلد ويظهر كبقع نزف صغيرة تحت الجلد بحجم رأس الإبرة تُعرف باسم الحبرات.
الأسباب لا يوجد سبب محدد لهذا السرطان، يوجد بضعة أسباب تسبب بضعة أنواع منه. السبب وراء أغلب أنواعه غير معروف، قد تكون الاسباب بسبب التاريخ العائلي للمرض والإشعاع المؤين والعلاج الكيميائي، ويختلف السبب باختلاف نوع السرطان. سرطان الدم ينتج عن طفرة بالمادة الوراثية من خلال تفعيل الجينات المسرطنة أو تعطيل الجينات الكابتة للورم وبالتالي تعطيل تنظيم موت الخلايا، والتمايز أو التقسيم هذه الخطوات من الممكن أن تحدث تلقائيَّاً (أي بدون أي مؤثر خارجي) أو من الممكن أنْ تحدث بسبب التعرُّض لإشعاع أيوني أو مواد مسرطنة . تعد الإشعاعات الأيونية الطبيعية والصناعية هي السبب الأكثر شيوعاً في البالغين كما أنَّ بعض الفيروسات كالفيروس البشري للنسيج اللمفاوي وبعض الكيماويات خصوصاً البنزين والمعالجة القاعدية الكيميائية قد تؤدي إلى هذا السرطان. إنَّ التدخين يزيد خطورة الإصابة بسرطان الدم النخاعي الحاد عند البالغين بنسبة بسيطة. من خلال بعض الدراسات مثل دراستي كوهورت و(حالة-تحكم) تم ربط التعرض لبعض الكيماويات البترولية وصبغات الشعر بالإصابة بسرطان الدم. إنَّ النِّظام الغذائي ليس له دور في الإصابة لكن تناول الخضروات قد يحمي. الفيروسات التي تمَّ إعازتها لهذا السرطان ومنها الفيروس البشري للنسيج Tاللمفاوي الذي يسبب سرطان الدم لخلايا T الليمفاوية البالغة. بعض الأفراد لديهم عامل وراثي لتطوُّر سرطان الدم والذي يُحدَّد عن طريق تاريخ العائلة ودراسات توين Twin study. إنَّ الناس المصابين لديهم جين واحد أو عدة جينات مشتركة. في بعض العائلات، الأفراد يصابون بنفس النوع من سرطان الدم وفي البعض الآخر يصابون بأنواع مختلفة أو أنواع مختلفة من السرطانات المرتبطة بالدم. الأفراد الذين يعانون من شذوذات كروموسوميه لديهم نسبة أكبر بالإصابة بهذا السرطان. فعلى سبيل المثال، المُصابين بمتلازمة داون لديهم نسبة خطر أكبر للإصابة بسرطان الدم (خصوصاً سرطان الدم الحاد). كذلك وجود طفرة في جينspred1 له دور بالإصابة بسرطان الدم خلال الطفولة. يتمُّ دراسة قدرة الإشعاعات غير المؤيَّنة على التسبب في مرض ابيضاض الدم منذ عقود عديدة. أخذت مجموعة عمل أخصائيّي المنظمة العالمية لأبحاث السرطان على عاتقها البحث المُفصل في جميع البيانات حول حقول الطاقة الكهرومغناطيسية الساكنة وذات التردد المنخفض التي تظهر طبيعيا عند توليد ونقل واستخدام الطاقة الكهربائية، توصَّلوا إلى أنَّ هناك أدلَّة محدودة على أنَّ التعرض لكميات كبيرة من الموجات المغناطيسية منخفضة التردد قد تسبب بعض أنواع ابيضاض الدم لدى الأطفال ولم يتم إثبات أي علاقة مع سرطانات الدم الأخرى والأورام لدى الكبار . حيث أنَّ التعرض لمثل تلك الكميات (إذا تم إثباته كعامل مسبب) أمر غير شائع . توصلت منظمة الصحة العالمية أنَّ مثل تلك الإشعاعات تسبب 100-2400 حالة من ابيضاض الدم لدى الأطفال سنويَّاً ما نسبته 0.2 إلى 4.9% من حالات ابيضاض دم الأطفال في تلك السنة وما نسبته 0.03-0.9% من جميع حالات ابيضاض الدم تم تسجيل بعض حالات ابيضاض الدم لدى الأطفال نتيجة انتقاله من الأم إلى الجنين في حالة إصابة الأم بابيضاض الدم أثناء الحمل وفقاً للدراسة التي أجراها مركز البحث في الأوبئة والصحة السكانية في فرنسا، فإنَّ الأطفال الذين يُولدون للأمَّهات اللاتي يستخدمن أدوية الخصوبة لتحفيز الإباضة تكون فرصتهم في الإصابة بابيضاض الدم في فترة الطفولة مرتين أكثر من الأطفال الآخرين
هناك عدة عوامل يمكنها أنْ تجعل الشخص عرضةً للإصابة بابيضاض الدم أكثر من غيره وهي: التعرض للإشعاعات. حيث تم ملاحظة أنَّ العاملين في الأشعة من أطباء وفنيين والمرضى الذين تم علاجهم من مرض التهاب الفقار المُقَسِط (Ankylosing Spondylitis) باستخدام الأشعة مقارنة بالمرضى الذين استُخدمَت معهم علاجات غير العلاج بالأشعة والناجين من القنبلة الذرية في هيروشيما وناكازاكي في اليابان جميعهم أظهروا نسبةً أعلى للإصابة بابيضاض الدم.
التعرض لبعض المركبات الكيميائية مثل الكلورمفينيكول (Chloramphenicol) والبنزين وبعض المضادات الحشرية. وهناك بعض الأدوية التي تستخدم في علاج السرطانات مثل فينيل ألانين الخل الذي يستخدم في علاج الورم النِقَوي المتعدد وبعض المواد القاعدية التي تستخدم في علاج مرض هودجكين وبعض الأدوية المثبطة مناعيّاً.
بعض الأمراض الوراثية مثل متلازمة داون ومتلازمة بلووم.
بعض الفيروسات مثل Human T-Lymphocyte بنوعيه الأول HTLV-1 والثاني HTLV-2 وذلك عن طريق إدخال جين ورمي (Oncogene) لخلايا الإنسان مما يجعلها سرطانية.
التشخيص

زيادة خلايا الدم البيضاء في ابيضاض الدم (اللوكيميا)
يتم تشخيص المرض مخبرياً وذلك بإجراء عدة فحوصات ومن أهمها العد الكامل لمكونات الدم (Complete Blood Count CBC) ومن خلال هذا الفحص يمكن إعطاء إشارات أولية باحتمال الإصابة بأبيضاض الدم.
الفحص السريري للكشف عن وجود تضخم في الكبد أو الطحال أوالعقد اللمفاوية
خزعة من نخاع العظم وذلك بفحص تلك الخزعة تحت المجهر بعد صبغها ببعض الصبغات الخاصة التي تشير إلى وجود أبيضاض في الدم.
في بعض الأحيان فحوص الدم لا تظهر إصابه المريض بسرطان الدم خصوصاً خلال بداية المرض أو خلال كُمون المرض أي بدون أعراض. في بعض أنواع السرطان يمكن استخدام خزعة من العقد اللمفاوية. بعد التشخيص يمكن إجراء فحوص الدم الكيميائية لتحديد الضرر المُصيب للكلية والكبد وتأثير العلاج الكيميائي على المريض. ومن الممكن استخدام x-ray وهي صوره الأشعة السينيه أو ultrasound الأشعة فوق الصوتية أو التصوير بالأشعة المغناطيسية MRI. وهذه الفحوصات تستخدم لكشف ضرر بالعظام (السينيه) أو الدماغ (ام ار أي) أو الكلية أو الطحال أو الكبد (فوق الصوتية). يمكن استخدام التصوير المقطعي المحوسب (ال سي تي) لفحص العقد اللمفاوية بالصدر ولكن هذه الطريقة نادره الاستخدام. بالرغم من استخدام هذه الطرق لتشخيص المريض إذا كان مصاب أم معافى، إلَّا أنَّ من الناس لم يتم تشخيصهم وسبب ذلك هو التشخيص الخاطئ لتشابه الأعراض مع أمراض أخرى. ولهذه السبب تقدر جمعية السرطان الأمريكية أنَّه على الأقل خُمسةٌ من الأشخاص الذين يعانون من سرطان الدم لم يتم تشخيصهم بالمرض.
المعالجة
هناك عدة طرق مستخدمة لعلاج ابيضاض الدم. بناء على حالة المريض وحدَّة المرض ونوع المرض يتم اتخاذ العلاج المناسب. ومن أكثر العلاجات استخداما: العلاج الكيميائي (Chemotherapy): ويتم فيه إعطاء المريض أدوية مثل (hydroxyurea, busulfan, etoposide, glivec ,tasigna ,daunorubicin) وغيرها للقضاء على الخلايا السرطانية.
العلاج بالأشعة (Radiotherapy): تعريض المريض للأشعة للقضاء على الخلايا السرطانية.
زراعة نخاع العظم (Bone Marrow Transplantation)
العلاجات المساعدة نقل دم: وذلك لمعالجه فقر الدم وعلاج النزيف.
مضادَّات حيويه (Antibiotics) وإنترفيرون (Interferon): ليتم دعم الجسم مناعياً ويجعله مُقاوِماً للأمراض.
سرطان الدم الحاد الليمفاوي
البؤرة التدبيريَّة العلاجية هي السيطرة على نخاع العظم وعلى المرض في جميع أجهزة الجسم (لكلِّ الجسم). بالإضافة إلى أنَّ العلاج يمنع الخلايا السرطانية من الانتشار إلى مناطق أخرى بالجسم وتحديدا الجهاز العصبي المركزي، فعلى سبيل المثال إجراء خزعةٍ من النخاع الشوكي شهرياً. بشكل عام الخطة العلاجية لهذا المرض تقسم إلى عدَّة مراحل: المرحلة الاستهلاكية أو الحثية: وتهدف للوصول إلى حالة استقرار نخاع العظم والخطة عند البالغين أو الخطة الاستهلاكيَّة تتكون من الأدوية برويليزون. فبكريسين وانثراسيكلين، والطرق العلاجية الأخرى تتكون من سيكلوفوسفيد ول-سباراجينياس. أَمَّا في الأطفال ذوي الخطورة العالية نستخدم برينليزون ول-اسباراجينياس وفينكيسترين.
الخطة العلاجية المركزة المكثفة تهدف إلى حصر عدد الخلايا السرطانية المتبقية. ولها عدّة طرق وبشكل تقليدي هي جرعه عالية من عدة علاجات وتتم خلال عدَّة أشهر، أمَّا ذوي الخطورة المتوسطة والمنخفضة يُعطى مضاد الأيض مثل الميثوكريكسيات و6-مركابتوبورون، وفي الخطورة العالية يعطون جرعات عالية من نفس الأدوية السابقة بالإضافة لأدوية أُخرى.
حماية الجهاز العصبي المركزي وهي حماية وقائية تتمثل بالعلاج الإشعاعي وقد تعطى بعض العلاجات مباشره داخل النُّخاع الشوكي.
العلاج الكيمائي وذلك للوقاية من عدم رجوع المرض وعادة تتكون من جرعه منخفضة من عدَّة علاجات وتستمر لثلاث سنوات.
كبديل في حالة المرض ذي الخطورة العالية يمكن عمل زرع نخاع العظم.
السرطان اللمفاوي المزمن
قرار المعالجة
وتعتمد على مرحلة المرض والأعراض . أغلبيَّة مرضى سرطان الدم اللمفاوي المزمن والذين لديهم درجه منخفضة من المرض لا يستفيدون من العلاج، والذين لديهم مضاعفات čيستفيدون من العلاج . بشكل عام المؤشرات للعلاج هي: هبوط مستوى خضاب الدم أو الصفائح الدموية.
تطور مرحلة المرض لمرحلة أخرى
تضخم مؤلم بالغدد اللمفاوية أو الطحال
زيادة في إنتاج عدد كريات الدم اللمفاوية
النهج العلاجيسرطان كريات الدم المزمن غير قابل للشفاء بالعلاجات الحالية. خطه العلاج الكيماوي هي تشكيلة من كلورامبوسيل أو سيكلوفوفسفايد بالإضافة إلى الكلوجوستيدويدات مثل بريدنيولون أو بريدنون . إنَّ استخدام الستيرويد له إضافة علاجيَّة بإحباط بعض الأمراض المناعية مثل فقر الدم أو نقص الصفائح المناعية، في بعض الحالات المستعصية يعطى العلاج المركب مع أدوية النيكليوسيد كالفلودرابين
والبينتوستاتين أو كلادربين وقد يكون ناجحاً في الحالات الأصغر سنَّاً يمكن زرع نخاع العظم وزرع النسيج الذاتي أو غير الذاتي.
سرطان الدم النقوي الحادعدد مختلف من العلاجات المضادة للسرطان فعّآلة في علاجه، المعالجة تختلف حسب العمر وحسب النوع الفرعي للسرطان. بشكل عام استراتيجية السيطرة على المريض تتمثل بالسيطرة على نخاع العظم وأجهزة الجسم كلِّها وتوفير علاج خاص للجهاز العصبي عند إصابته. وبشكل عام أغلبية أخصَّائي الأورام يعتمدون على تركيبة العلاجات المتعددة للمعالجة الحثية الاستهلاكية مثل هذا النهج المتعدد الدوائي عادةً ما يوفر السكون المرضي وانخفاض في خطورة مقاومة المرض للعلاج، العلاج المكشف والصياني تُعطى للوقاية من رجوع المرض وتُعطَى بهذه المرحلة نفس الأدوية في مرحله الحث وأدوية أخرى . كما أَنَّ العلاج الصياني يُعطى بجرعات أقل من الحثي. أما في حاله السكون المرضي فإنَّ العلاج الصياني يكون بجرعات أقل من جرعات العلاج الحثي.
سرطان الدم النقوي المزمنهناك عدة احتمالات والشكل الرئيسي للعلاج عند المرض الحاد ويشمل بإعطائهم ايماتينيب هذا العلاج بالمقارنة مع العلاجات الأخرى له مميزات منها قلَّة الآثار الجانبية ويُعطى عن طريق الفم. وبهذا العلاج يكون أكثر من 90 بالمائة تحت السيطرة لمده خمس سنوات ولهذا يصبح مزمن يمكن علاجه. أمَّا في الحالات المتقدمة عند فقدان السيطرة أو عدم المريض للعلاج أو عند رغبة المريض بالشفاء كليَّاً من المرض يمكن استخدام عمليه زرع نخاع العظم من مصدر غير ذاتي. وهذه الزراعة قد يدخل ضمنها العلاج الشعاعي والكيمائي و30 بالمائة من المصابين يموتون بعد القيام بهذه العملية.
الخلايا الشعورية
عندما لا يوجد أعراض عند المريض فإنَّه لا يُعطى أيُّ علاج . بشكل عام يعطى علاج يعتبر ضروري عندما تظهر على المصاب علامات وأعراض كعدد خلايا الدم المنخفض (على سبيل المثال، معدل خلايا مكافحة العدوى أقل من 1.0 K / ميكرولتر) والالتهابات المتكررة والكدمات غير المبررة وفقر الدم أو التعب والتي هي كبيرة بما يكفي لتعطيل حياة المريض اليومية.
النهج العلاجي التقليدي إنَّ المريض الذي قد يحتاج معالجة سوف يتناول كلاديبن لأسبوع ويُعطى عن طريق الوريد أو جرعه تحت الجلد أو يمكن أن يتناول بيتوستاتين لمدة أربعه أسابيع . وفي كثير من الحالات دورة واحدة من العلاج ينتج عنها توقُّف للمرض لفترة طويلة.هناك علاجات أخرى تُعطى مثل ريتوكسياب من خلال الوريد مع انترفيرون ألفا، أو في حالات محدودة يمكن للمريض الاستفادة من إزالة الطحال، مثل هذه العلاجات لا تُعطى منذ البداية لأنَّ احتمال نجاحها أقل من الكلدريبين أو البينتوستاتين.
ابيضاض الدم T-prolymphocyticمعظم المرضى المصابين ب ابيضاض الدم t-cell prolymphcytic (وهو نوع نادر جداً وعنيف، متوسط الحياة يقل عن السنة الواحدة) يتطلبون علاجاً فورياً .هذا النوع من ابيضاض الدم صعب العلاج ولا يستجيب لمعظم العلاجات الكيماوية المتوافرة. تم تجربة علاجات مختلفة ولاقت نتائج محدودة في مرضى معينين مثل: أشباه البيورين (pentostatin, fludarabine, cladribine)، chlorambucil، وتوليفات متنوِّعة من العلاجات الكيماوية (cyclophosphamide, doxorubicin, vincristine, prednisone CHOP, cyclophosphamide, vincristine, prednisone [COP], vincristine, doxorubicin, prednisone, etoposide, cyclophosphamide, bleomycin VAPEC-B). Alemtuzumab مضاد أحادي النسيلة يهاجم خلايا الدم البيضاء تم استخدامه كنوع من العلاج ولاقى نجاح أكبر من الخيارات السابقة. بعض المرضى الذين يستجيبون للعلاج يخضعون أيضاً لزراعة الخلايا الجذعية لتدعيم استجابتهم للعلاج.
سرطان ابْيِضاضٌ وَحيدِيٌّ نِقَوِيّ اليَفَعِيّ (Juvenile myelomonocytic)علاج هذا النوع من السرطان يمكن أن يكون باستئصال الطحال والعلاج الكيميائي، وزراعة نخاع العظم.
علم الأوبئة

حسب السن نسب الوفيات جراء ابيضاض الدم لكل 100,000 نسمة في عام 2004.
في عام 2010 تُوفِّي حوالي 281,500 شخص بابيضاض الدم حول العالم. وفي عام 2000 طوَّر حوالي 256,000 طفل وبالغ شكلاً من أشكال اللوكيميا حول العالم، وتوفي منهم 209,000 . يمثل هذا حوالي 3% من سبعة ملايين حالة وفاة بسبب السرطان في ذلك العام وحوالي 0.35% من إجمالي الوفيات لأسباب مختلفة. من المواقع الـستّة عشرة المنفصلة التي تم مقارنتها كان مرض ابيضاض الدم في المرتبة الثانية عشرة في تصنيف الأمراض الأكثر شيوعاً والحادي عشر من حيث الوفيات لأسباب تتعلق بالسرطان.
الولايات المتحدةتتأثر حوالي 245,000 شخص في الولايات المتحدة ببعضٍ من أشكال سرطان الدم بما في ذلك تلك التي حققت علاج. وزادت المعدلات 1975-2011 بنسبة 0.7٪ سنويَّاً بين الأطفال. تم تشخيص ما يقرب من 44270 حالة جديدة من سرطان الدم في عام 2008 في الولايات المتحدة. وهذا يُمثِّل 2.9٪ من جميع حالات السرطان (باستثناء الخلايا القاعدية بسيطة والجلد الحرشفية الخلايا السرطان) في الولايات المتحدة، و30.4٪ من جميع سرطانات الدم.من بين مجموع الأطفال الذين يعانون من أي شكل من أشكال السرطان، حوالي الثلث يعانون من سرطان الدم، الأكثر شيوعاً من هذه الأنواع سرطان الدم الليمفاوي الحاد. وهناك نوع من سرطان الدم هو الشكل الثاني الأكثر شيوعا من بين أنواع السرطان في الأطفال (دون سن 12 شهرا) والشكل الأكثر شيوعا من بين أنواع السرطان في الأطفال الأكبر سنا. البنين إلى حدٍّ ما أكثر عرضة للإصابة بسرطان الدم من الفتيات، والأطفال الأميركيين البيض لديهم ضعف احتماليَّة الإصابة بسرطان الدم للأطفال الأمريكيين السود. فقط حوالي ٪3 من حالات السرطان المُشخَّصة عند البالغين تكون للوكيميا، ولكن لأنَّ السرطان أكثر شيوعا بين البالغين يتم تشخيص أكثر من 90% من سرطانات الدم عند البالغين.أصول الأفراد هو أحد عوامل الخطر في الولايات المتحدة؛ اللاتينيين وخاصة من هم دون سن ال 20 هم الأكثر عرضة لسرطان الدم. في حين البيض الأميركيين الأصليين والأميركيين الآسيويين وسكان ألاسكا الأصليين هم أكثر عرضة من الأميركيين الأفارقة.الجنس هو أيضاً أحد عوامل الخطر؛ الرجال هم الأكثر إصابة بالمرض ويموتون بسببه بنسبة أكبر من النساء. حوالي 30 في المائة الرجال أكثر من النساء بنسبة الإصابة بسرطان الدم. سرطان الدم أكثر شيوعا في الدول المتقدمة.
المملكة المتحدةعموماً سرطان الدم هو الحادي عشر من أكثر أنواع السرطان شيوعا في المملكة المتحدة (تم تشخيص حوالي 8600 شخص يعانون من هذا المرض في عام 2011) وهو السبب التاسع من الأسباب الأكثر شيوعا لوفيات السرطان (توفي حوالي 4800 شخص في عام 2012).
التاريخرودولف فيرشو وُصف ابيضاض الدم للمرة الأولى على يد المُشرّح والجرّاح الفرنسي ألفرد-أرمند-لويس-ماري-فيلبو عام 1827. أعطى اختصاصي الباثولوجيا رودولف فيرشو وصفًا أكثر شمولية عام 1845. بعد أن رأى فيرشو عدد كبير بشكل غير طبيعي لخلايا الدم البيضاء في عينة من دم المريض . أطلق فيرشو على الحالة اسم لوكيميا (Leukämie) باللغة الألمانية، والتي تتشكل من الكلمتين اليونانيتين لويكوس (leukos; λευκός)، والتي تعني «أبيض»، وهيما (haima; αἷμα)، والتي تعني «دم». بعد نحو عشر سنوات من نتائج فيرشو، وجد اختصاصي الباثولوجيا الألماني فرانتس إرنست كريستيان نومان أنَّ نخاع العظم في متوفي مريض ابيضاض الدم كان ذو لون «أخضر-أصفر قذر» بدلاً من اللون الأحمر العادي. استنتج نومان من هنا أنَّ مشكلة في نخاع العظم هي المسؤولة عن الدم غير الطبيعي في مرضى ابيضاض الدم. بحلول القرن العشرين اعتُبر ابيضاض الدم كمجموعة من الأمراض بدلًا من مرض واحد. وبحلول عام 1947 اعتقد اختصاصي الباثولوجيا من بوستون «سيدني فاربر» من تجارب سابقة أنَّ الأمينوبتيرين، وهو تقليد لحمض الفوليك، قد يشفي ابيضاض الدم في الأطفال. وقد أظهر معظم الأطفال مُصابي ابيضاض الدم اللمفاوي الحاد الذين فُحصوا علامات تحسُّن في نخاع العظم، ولكن لم يُشفى أيًا منهم في الواقع. ومع ذلك أدَّى ذلك إلى مزيد من التجارب. في عام 1962، استخدم الباحثَين إميل ج. فريريخ جونيور وإميل فري الثالث العلاج الكيميائي في محاولة لعلاج ابيضاض الدم. نجحت التجارب مع بعض المرضى الذين بقُوا على قيد الحياة فترة طويلة بعد التجربة.
المجتمع والثقافةوفقا لسوزان سونتاغ: إنَّ لسرطان الدم طابعاً رومانسياً في القرن العشرين، صُّور على أنه ينهي الفرح، المصابين هم ضحايا أبرياء ماتوا صغاراً أو في الوقت غير المناسب. على هذا النحو وكانت الخليفة الثقافية له هو مرض السل، الذي حمل هذا اللقب الثقافي حتى اكتشف أنه أحد الأمراض المعدية.
الرواية الرومانسية (قصة حب) هي مثال على تفسير الرومانسية في سرطان الدم.
في الولايات المتحدة أُنفق حوالي 54 بليون دولار على العلاج في السنة.
اتجاهات البحوثيتم تنفيذ بحوث مهمة في الأسباب والانتشار والتشخيص والعلاج والتشخيص لسرطان الدم. ويجري التخطيط لمئات من التجارب السّريرية له
وتركز الدراسات على وسيلة فعّآلة للعلاج وأفضل الطرق لعلاج هذا المرض وتحسين نوعية الحياة للمرضى أو الرعاية المناسبة خلال أو بعد العلاج.
بشكل عام هناك نوعان من بحوث سرطان الدم: البحوث السريرية أو التفسيرية والبحوث الأساسية. وتركز البحوث السريرية / البحوث التفسيرية على دراسة هذا المرض بطريقة محددة وغير محدده بطرق تناسب المريض؛ مثل اختبار دواء جديد في المرضى. على النقيض من ذلك تدرس البحوث العلمية الأساسية المرض بأبعاد أخرى؛ مثل رؤية ما إذا كانت مادة مُسرطنة يمكن أن تسبِّب تغيرات اللوكيميا في الخلايا المعزولة في المختبر أو كيف يتغير DNA داخل خلايا سرطان الدم. النتائج من الدراسات البحثية الأساسية عادة ما تكون أقل إفاده للمرضى الذين يعانون من هذا المرض.ويجري حالياً متابعة العلاج عن طريق العلاج الجيني. وإحدى هذه الطرق تستعمل خلية تائية (T cell) لمهاجمة الخلية السرطانية. في عام 2011 بعد عام من إجراء العلاج اثنين من ثلاثة مرضى شفوا من سرطان الدم الليمفاوي المزمن وفي عام 2013 ثلاثة من خمسة اشخاص الذين عانوا من سرطان الدم الليمفاوي الحاد أصبح لديهم حالة من الخمود لمدة خمسة أشهر أو عامين يجري حالياً تحديد الخلايا الجذعية التي تسبب أنواع مختلفة من سرطان الدم.
الحملنادراً ما يرتبط سرطان الدم مع الحمل. يؤثر فقط في حوالي 1 من 10.000من النساء الحوامل. طريقة التعامل مع المرض تعتمد بالدرجة الأولى على نوع سرطان الدم. تقريباً جميع سرطانات الدم التي تظهر عند النساء الحوامل هي سرطانات الدم الحادة. اللوكيميا الحادة تتطلب عادة علاج عدواني سريع. على الرغم من المخاطر الكبيرة لفقدان الحمل والتشوهات الخلقية وخاصة إذا تم إعطاء العلاج الكيميائي أثناء الأشهر الثلاثة الأولى والتي هي حساسة لحالة الطفل التنموية.ويمكن علاج سرطان ابيضاض الدم النقوي المزمن في أي وقت خلال فترة الحمل باستخدام الهرمونات إنترفيرون ألفا. علاج اللوكيميا اللمفاوية المزمنة والذي هو نادر عند النساء الحوامل يمكن تأجيله إلى ما بعد نهاية الحمل.
الأبحاثوجدت مجموعة بحث أن لمركب سكلاريول القدرة على إحداث أثر الاستماتة على بعض أنواع خلايا مرض ابيضاض الدم.
انظر أيضاًسرطان الدم الليمفاوي الحاد
سرطان الدم النقوي الحاد
سرطان الدم الليمفاوي المزمن
سرطانة خلايا الدم
أمراض الدم
سرطان الغدد الليمفاوية
ألفرد فرانسوا دونيه
جون هيوز بينيت
========
لوكيميا الأرومة اللمفاوية الحادة{{{من ويكيبيديا، الموسوعة الحرة
لوكيميا الأرومة اللمفاوية الحادة

نضح العظم تشويه من شخص مع السلائف B- الخلية ALL. الخلايا الأرجواني الكبيرة هي الأورام اللمفاوية.
معلومات عامة
الاختصاص علم الأورام
من أنواع لوكيميا حادة، ومرض
المظهر السريري
الأعراض حمى و، وضعف، وإعياء، وفقدان الوزن، وفقدان الشهية، وآلام العظم، وألم البطن، وضيق النفس
أدوية{{تينيبوسيد
لوكيميا الأرومة اللمفاوية الحادة أو ابيضاض الدم الليمفاوي الحاد (بالإنجليزية: Acute Lymphocytic Leukemia) هو مرض سرطاني يحدث بسبب تكاثر غير طبيعي للخلايا الأرومية الليمفاوية في نخاع العظم.
يتم تشخيص 4000 حالة سنويا في الولايات المتحدة وبمعدل إصابة 1.4/100000 شخص. يصيب البالغين وخاصة من عمر الخمسين فما فوق، ويعد من أكثر السرطانات شيوعا في مرحلة الطفولة وخاصة ما بين الأطفال من 3-7 سنوات حيث يشكل ما نسبته 30% من الأمراض السرطانية التي تصيب الأطفال.
يعد أبيضاض الدم الليمفاوي الحاد الذي يصيب الخلية الليمفاوية من نوع B الأكثر شيوعا ونسبة الأصابة به ما بين الذكور والإناث متساوية، على عكس المرض الذي يصيب الخلية الليمفاوية من نوع T حيث تظهر الإحصاءات نسبة اصابة أعلى في الذكور من الإناث 1.3: 1.0.
سبب الإصابة{{ أبيضاض الدم؛ مسببات المرض
لا يعرف ماهو المسبب الرئيسي للمرض إلا أن الإشعاعات الناتجة من القنبلة الذرية وبعض المركبات الكيميائية مثل البنزين يكون لها دور في التسبب بالمرض.
الأعراض
تظهر الأعراض تدريجيا على المريض وقد تأخذ أسابيع إلى عدة أشهر وقد تظهر بشكل مفاجئ وحاد. تكون الأعراض بشكل عام: شحوب وضيق في النفس وبعض التوعكات وذلك بسبب فقر الدم الحاصل.
ارتفاع حرارة المريض وذلك بسبب تكاثر الخلايا السرطانية.
آلام في المفاصل والعظام بسبب تسلل الخلايا السرطانية للسمحاق وتآكل العظم. مما يسبب اضطرابات في المشي وخاصة عند الأطفال مما يجعلهم رافضين للمشي على الأقدام
كدمات ونزيف تحت الجلد ونزيف من اللثة نتيجة نقص الصفائح الدموية.
تضخم في الكبد والطحال والغدد الليمفاوية.
يظهر ما نسبته 2% من حالات الإصابة بالمرض عند الأطفال وجود الخلايا السرطانية في سائل النخاع الشوكي مما يسبب صداع وتقيأ. وما نسبته 10% عند البالغين.
وجود بعض الأورام في منطقة الصدر وخاصة عند البالغين المصابين بالمرض من نوع السلسلة T.
الرغبة الملحة في النوم للشعور بالإرهاق الشديد.
عدم وجود رغبة لتناول الطعام أو الشراب.
التصنيف
تم تصنيف المرض بالاعتماد على شكل الخلايا السرطانية أو النمط الظاهري المناعي بواسطة مجموعة من العلماء الفرنسيين والأميركيين والبريطانيين (فاب) إلى: تصنيف حسب شكل الخلايا السرطانية: L1 وتكون الخلايا الأرومية موحدة الشكل وصغيرة وتتميز أيضا بقلة ومحدودية سائل السايتوبلازم.L2 وتكون الخلايا الأرومية أكبر من النوع السابق ومتغير وكذلك وجود نوية ويكون سائل السيتولازم أكثر تعقيدا لاحتوائه على بعض العضيات.L3 خلايا أرومية أكبر من الأنواع السابقة مع نوية أكثر بروز ونضج من النوية السابقة وسائل سايتوبلازمي شديد القاعدية ووجود بعض الفجوات فيه. النمط الظاهري المناعي:
و يتم تقسيم المرض إلى نوعين وذلك بحسب عناقيد التمايز (Clusters of Differentiation) الموجودة على الخلايا الآرومية أبيضاض دم ليمفاوي حاد من نوع B وتصل نسبتها إلى 78% من الحالات.
أبيضاض دم ليمفاوي حاد من نوع T تشكل 22% من حالات الإصابة.
الإمراض الجزيئي
وجد العديد من الاضطرابات والاعتلالات الجزيئية في مرضى أبيضاض الدم الليمفاوي الحاد من أهمها: الاتحاد الجيني ما بين المورثة ABL والمورثة BCR (أو كما يعرف بكروموسوم فيلادلفيا) الناتج من الانتقال المكاني بين الكروموسومين 9 و 22 (t(9;22)q(34;q11 مما يؤدي إلى عمليات نقل إشارة لبروتينات لها دور في نمو الخلايا. 20-30% من حالات الإصابة عند البالغين، بينما لا تتعدى أكثر من 3% في حالات الإصابة عند الأطفال.
حدوث طفرات جينية في عدد من العوامل الناسخة التي لها دور رئيسي في عملية تكوين الدم. مثل عملية الانتقال المكاني بين الكروموسومين 12 و 21 (t(12;21)q(13;q22 مما ينتج تجاور للمورثتين AML1 و TEL.
حدوث اضطرابات في المورثات المثبطة للأورام مثل حذف أجزاء من المورثتين (p16(INK4A و(p15(INK4B
مآل المرض
هناك عدة عوامل ممكن أن تحدد مآل المرض كما يبينها الجدول.
العوامل المحددة لسير المرض
العامل جيد سيئ
عدد كريات الدم البيض منخفض مرتفع
الجنس إناث ذكور
النمط الظاهري المناعي B T
العمر طفل بالغ
الوراثة الخلوية صورة طبيعية أو TEL كروموسوم فيلادلفيا
مدة إزالة الخلايا الأرومية من الدم أقل من إسبوع أكثر من إسبوع
مدة تهدئة المرض أقل من 4 أسابيع أكثر من 4 أسابيع
وجود أعراض إصابة الجهاز العصبي المركزي غير موجودة موجودة
الحد الأدنى من بقايا المرض غير موجودة من فترة 1-3 شهور موجودة بعد 3-6 شهور
التشخيص المخبريعد كامل لمكونات الدم (Complete Blood Count) وقد يظهر هذا الفحص زيادة في أعداد كريات الدم البيضاء وفي بعض الحالات تكون ضمن العدد الطبيعي. ويظهر الفحص أيضا هبوط في مستوى الهيموكلوبين والصفائح.
أخد خزعة من نخاع العظم لدراسته نسيجيا. معظم الحالات تظهر وجود أعداد كبيرة من الخلايا الآرومية (ما لا يقل عن 90% من الخلايا).
التهجين الموضعي المتألق وذلك لدراسة الخلايا السرطانية وملاحظة وجود أية اختلالات وراثية (انتقالات مكانية أو حذف لأجزاء من الكروموسومات). معرفة نوع الاضطراب الخلوي قد يساعد الطبيب على توقع مسار المرض.
النمط الظاهري المناعي: وذلك بدراسة عناقيد التمايز الموجودة على الخلايا الأرومية وتحديد نوع المرض (B أو T) وهذا العامل أيضا له دور في تحديد مسار المرض.
العلاج
يتم علاج المرض بواسطة عدة طرق مثل العلاج الكيميائي والعلاج بالأشعة وزراعة نخاع العظم الخيفي واستخدام الأضداد وحيدة النسيلة (Monoclonal Antibodies) إلا أن العلاج الأخير ما زال تحت التجارب السريرية.
العلاج الكيميائي
تتم تقسيم عملية العلاج إلى عدة مراحل
1. تهدئة المرض: في هذه المرحلة الهدف الرئيسي من العلاج هي محاولة القضاء على الخلايا السرطانية والوصول إلى مرحلة التهدئة وتتمثل بعدم زيادة نسبة الخلايا الأرومية في نخاع العظم عن 5% وصورة طبيعية للدم المحيطي وعدم وجود أية أعراض للمرض. يتم علاج المريض بواسطة بردنيسلون (Prednislone) وديكساميثاسون (Dexamethasone) وفينكريستين (Vincristine) وأسبارجنيز (Asparginase). يتم الوصول إلى التهدئة في 90% من الحالات الإصابة بالمرض عند الأطفال و 80 - 90% من حالات الإصابة عند البالغين.
2. تكثيف العلاج: يتم دمج عدة أدوية مع بعضها وتعطى للمريض بهدف محاولة القضاء على المرض أو تقليل الخلايا السرطانية بشكل كبير إلى مستويات ضئيلة جدا. أدوية مثل فينكريستين (Vincristine) وسيكلوفوسفامايد (cyclophsphamide) وسايتوسين أرابينوسايد (Cytosine Arabinoside) وثايوكوانين (Thioguanine) وإيتوبوسايد (Etoposide) ومركابتوبيورين (Mercaptopurine) تعطى للمريض على شكل توليفات مختلفة حسب حالة المريض وقدرته على التحمل.
3. مداومة العلاج: وتستمر من 2-3 سنوات، يعطى المريض جرعة يومية عن طريق الفم من مركابتوبيورين (Mercaptopurine) وجرعة إسبوعية من ميثوتركسيت (Methotrexate). يتم تقليل العلاج تدريجيا عن التأكد من عدم وجود الحد الأدنى من بقايا المرض (Minimal Residual Disease).
في بعض الحالات التي يتم فيها انتشار الخلايا السرطانية في الجهاز العصبي المركزي يتم علاج المريض بواسطة ميثوتركسيت (Methotrexate) أو عن طريق التشعيع القحفي (Cranial Irradiation) إلا أنه بفضل عدم استخدام التشعيع القحفي مع المصابين من الأطفال.
طرق أخرى للعلاجزراعة نخاع العظم الخيفي في بعض الحالات التي لا تبدي أي تقدم أو تحسن عند استخدام العلاج الكيميائي. إلا أن لهذا العلاج يتوجب بعض الشروط مثل عمر المريض وحالته ووجود متبرع مناسب، وينطوي هذا العلاج على بعض المخاطر مثل عدم نجاح الزراعة مما يؤدي إلى تحفيز المريض مناعيا ومرض المريض ضد الطعم.
استخدام علاج إيمينتاب للمرضى المصابين بكروموسوم فيلادلفيا ويظهرون وجود الاتحاد الجيني BCR-ABL.
استخدام الأضداد وحيدة النسيلة. ويتم توجيه هذه الأضداد إلى الخلايا السرطانية بحسب عناقيد التمايز التي تظهرها. أظهرت الأبحاث أن استخدام روتكسيماب (Rituximab) -موجه ضد عنقود التمايز 20- وكامباث 1 (Campath-1) - موجه ضد عنقود التمايز 52 - مع العلاج الكيميائي يعطي نتائج جيدة. بعض الأدوية لعناقيد تمايز أخرى ما زالت تحت التجارب السريرية
معرض صور



======
بيضاض الدم الليمفاوي المزمن{{من ويكيبيديا، الموسوعة الحرة
ابيضاض الدم الليمفاوي المزمن

مسحة الدم المحيطي تظهر خلايا CLL
معلومات عامة
الاختصاص علم الدم
من أنواع ابيضاض الدم المزمن، ولمفوما، وابيضاض الدم،
أدوية{{{{{يوراموستين، وأليمتوزوماب، ومركابتوبورين، وسيكلوفوسفاميد، وكلورامبوسيل، وبيغاسبارغاس، وكلادريبين، وإيفوسفامايد، وبريدنيزون، وبينداميوستين، وليناليدوميد، وبنتوستاتين، ونيلوتينيب، وبيغفيلغراستيم، ودوكسوروبيسين، وإبروتينيب/ وديكساميتازون، وفينيتوسلاكس، وفينكريستين، وريتوكسيماب، وأوفاتوموماب، وأوبينوتوزوماب، وكلورامبوسيل، وسيكلوفوسفاميد، وفينيتوسلاكس
=========
ابيضاض الدم الليمفاوي المزمن (بالإنجليزية: Chronic Lymphocytic Leukemia) هو مرض سرطاني يصيب الخلية الليمفية من نوع B.
يصيب البالغين وخاصة الأفراد التي تتراوح أعمارهم ما بين 60- 80 عاما خاصة في أوروبا وأميركا الشمالية، وينتشر بين الذكور بنسبة أعلى من الإناث (1:2). يشكل ما نسبته 25% من الإصابات بمختلف أمراض أبيضاض الدم. في أميركا الشمالية، معدل الإصابة السنوي للرجال 3.35-3.69 لكل 000 100 شخص، أما بالنسبة للنساء هو 1.61-1.92 لكل 000 100 شخص. يتصف المرض بالتراكم التصاعدي للخلايا الليمفية في نخاع العظم والعقد الليمفية، وبالتالي انتقال المرض تدريجيا إلى بقية الأعضاء المصنعة للدم. يتم إيعاز المرض إلى خلل جزيئي يؤدي إلى تأخير أو إعطاب عملية استموات الخلايا.
أسباب المرض
بخلاف بقية أنواع أبيضاض الدم، لم يتم ربط الإصابة بالمرض مع عوامل مخطرة بيئية أو التعرض لأي مركبات كيميائية أو أشعة. أحد العوامل المخطرة المرض هو وجود إصابة بهذا المرض أو أية اضطرابات تكاثر ليمفي في أحد أفراد العائلة، وجد أن مصاب من كل 10 أشخاص مصابين بأبيضاض الدم الليمفي المزمن لديهم إصابة عائلية بالمرض.
الفسيولوجيا المرضية
وجد الباحثون أن من ميزات المرض هو تراكم وتكدس الخلايا الليمفية وليس من الانقسام الغير طبيعي للخلايا. ومن هنا تم ربط المرض بعملية استموات الخلايا. تتم عملية استموات الخلايا من خلال طريقين رئيسين هما الطريق الداخلي (ميتكوندريا) والطريق الخارجي (TNF). تتضمن عمليات نقل إشارة وتنشيط وتثبيط مركبات معينة تؤدي بالنهاية لتحفيز عملية استموات الخلايا.
في أبيضاض الدم الليمفي المزمن تتدخل عدة بروتينات في الطريقين الداخلي والخارجي مما يؤدي إلى تثبيط عملية استماتة الخلايا. مثل هذه البروتينات عائلة بي سي إل 2 و NF-KB و Akt. ووجد أيضا أن بعض الاضطرابات الوراثية الخلوية تؤدي إلى إخلال في عمل المورثة بي53 المسؤولة عن تثبيط الأورام.
الأعراض
معظم حالات اكتشاف المرض تتم بالصدفة من خلال الفحوصات الروتينية أو بسبب ظهور أعراض فقر الدم أو تضخم متماثل في الغدد الليمفاوية وخاصة التي تقع في منطقة العنق والإبط، تظهر 3/2 الحالات تضخم في الكبد أوالطحال. وتظهر بعض الحالات تضخم في اللوزتين وبعض الكدمات لقلة الصفائح الدموية.
العلامات المخبرية
تظهر الفحوصات المخبرية ارتفاع في أعداد كريات الدم البيضاء الليمفية ووجودها بما نسبته 40% أو أكثر في نخاع العظم. في صورة الدم، تظهر الخلايا بأحجام صغيرة وكمية السايتوبلازم تكون ضئيلة ولا تظهر النوية بشكل واضح.
يشاهد في صورة الدم خلايا تعرف باسم سلائف الليمفيات، وتكون كبيرة الحجم مقارنة بالكريات الليمفية ولا تزيد عن 5%. في بعض الحالات المرضية تشاهد بنسبة أعلى، في تلك الحالة يتم تشخيص الحالة كنوع من أنواع المرض ويسمى أبيضاض الدم الليمفي المزمن/سلائف الليمفيات.
فحص نقي العظم{{{{{{{فحص نخاع العظم
يشكل فحص نقي العظم أهمية كبيرة في عملية تشخيص المرض، ومتابعة العلاج. تكمن أهميته في النقاط التالية: وسيلة لتحديد مآل ومرحلة المرض: عندما يكون نخاع العظم مكدس بالخلايا الليمفية مع عديد قليل جدا من المناطق الدهنية (النمط المنتشر)، هذا يؤشر إلى أن المرض في مرحلة متأخرة وبالعادة يكون مآل المرض سيئ. وقد يكون نمط نخاع العظم خلالي مع وفرة المساحات الدهنية أو يكون نمط عقدي الشكل. بعض الإصابات تظهر مزيج من النمطين الأخيرين.
تحديد طبيعة ومسبب قلة الحُمُر والصفائح: يساعد فحص نخاع العظم على تحديد مسبب قلة الخلايا في الدم وبالتالي معالجة المسبب.
التشخيص التفريقي مع الأمراض الأخرى: يتم ملاحظة نمط ترشيح الخلايا الليمفية يساعد على تشخيص أبيضاض الدم الليمفي المزمن من بقية الأمراض التي تتشابه معه.
متابعة واستجابة المريض للعلاج.
مآل المرض
هناك عدة عوامل لها دور في تحديد مآل المرض.
عوامل محددة لمآل المرض
العامل جيد سيئ
مرحلة المرض بينت A راي (0-I) بينت B,C راي (II-IV)
الجنس انثى ذكر
مدة تضاعف الليمفيات بطيئ سريع
نمط خزعة نخاع العظم عقدي منتشر
الوراثة الخلوية حذف 13q4 حذف 17p، حذف 11q23، تثلث صبغي 12
مورثة VH مطفرة طبيعية
تعبير CD38 قليل مرتفع
تعبير ZAP-70 قليل مرتفع
أنظمة تحديد مرحلة المرضهنالك نظامان يستخدمان لتحديد مرحلة المرض، النظام الأول، نظام راي (1975)، قسمت مجموعة راي المرض لعدة مراحل:مرحلة 0: تتصف بارتفاع كريات الدم البيضاء الليمفاوية فقط
مرحلة I: تضخم في الغدد الليمفاوية
مرحلة II: تضخم في الكبد أو الطحال أو كلاهما
مرحلة III: فقر الدم
مرحلة IV: هبوط في الصفائح
النظام الآخر هو نظام بينت (1981).
طور بينت هذا النظام بالاعتماد على دراستين فرنسيتين. يتم تقسيم مراحل المرض بالاعتماد على عدد الأعضاء اللمفاوية المتضخمة (العنق والإبط والمنطقة الأربية والكبد والطحال) كالتالي: A: ارتفاع كريات الدم البيضاء الليمفاوية فقط مع عدم وجود أي تضخم أو تضخم عضوين أو أقل
B: تضخم 3 أعضاء أو أكثر
C: وجود فقر دم أوانخفاض في الصفائح الدموية
الوراثة الخلوية
أظهرت الأبحاث أن ما نسبته 80% على الأقل من حالات الإصابة بالمرض تحوي على اضطراب وراثي خلوي أو أكثر. يتم تشخيص هذه الاضطرابات بواسطة فحص التهجين الموضعي المتألق، لما لها من دور في تحديد مآل المرض. صدرت دراسة في عام 2000 قام بها دونر ومجموعته بدراسة 325 مريض وخرجوا بمجموعة من الاضطرابات الوراثية الخلوية ورتبوها حسب دورها في مآل المرض من السيئ إلى الجيد.
الاضطرابات الوراثية الخلوية حسب دراسة دونر مرتبة حسب دورها في مآل المرض
الاضطرابات الوراثية الخلوية نسبة الإصابة
حذف 17p 7%
حذف 11q 17%
تثلث صبغي 12 14%
نمط نووي طبيعي 18%
حذف 13q4 36%
غيرها 8%
مورثة VH
كان الاعتقاد السائد أن المرض يحدث في الخلايا الليمفية التي تحوي نسخة طبيعية من مورثة VH. إلا أنه اكتشف حديثا أن أكثر من نصف حالات المرضى (55%) يحملون مورثة VH مُطفّرة. تكمن أهمية حدوث هذه الطفرة لتعزز قدرة الخلايا الليمفية على إنتاج أضداد متخصصة. وجدت الدراسات أن الأشخاص الذين يحملون النسخة المطفرة من المورثة يكون مآل المرض أفضل من المرضى الذين يحملون النسخة الطبيعية. يتم التحري عن هذه الطفرة إما بقياس كميات CD38 في الخلايا الليمفية أو التحري عن التعبير الجيني لمورثة ZAP-70. كلاهما ينتج بكميات أكبر في حالة المورثة الطبيعية.
التشخيص التفريقي
تشتبه بعض الأمراض في الأعراض والظواهر مما تجعل مهمة التشخيص صعبة في بعض الأحيان مثل هذه الأمراض متلازمة ريختر وأبيضاض الدم الليمفي المزمن العائلي وكثرة الليمفيات البائية الوحيدة ومتعددة النسيلة.
تم تطوير نظام نقاط حتى يتم التفريق بين أبيضاض الدم الليمفي المزمن وغيره وذلك بالاعتماد على وجود بعض المؤشرات. هناك 5 مؤشرات يتم التحري عنها بواسطة جهاز عداد الخلايا. كل منها يشكل نقطة واحدة. تحسب النقاط بعدها ويتم تشخيص المرض بالاعتماد على تلك المؤشرات.
العلاج
تتم معالجة المرض بعدة طرق: العلاج الكيميائي: ويستخدم للقضاء على الخلايا السرطانية ومنعها من الانقسامز مثل كلورامبيوسيل (Chlorambucil) وفلودارابين (Fludarabine).
العلاج الإشعاعي: يتم تعريض المريض للأشعة العلاجية لتقليص حجم الغدد الليمفية والتي لا تستجيب للعلاج الكيميائي.
الأضداد وحيدة النسيلة: يتم استخدام الريتوكسيماب (Rituximab) للقضاء على الخلايا السرطانية.
زراعة نخاع العظم.
===
سرطانة خلايا الدم{{{{{من ويكيبيديا، الموسوعة الحرة
سرطانة خلايا الدم

حالة من سرطانة خلايا الدم. الخلايا المستديرة الكبيرة هي خلايا سرطان الثدي تنتشر في الدم المحيطي.
تسميات أخرى سرطانة خلايا اللوكيميا
معلومات عامة
الاختصاص علم الدم، علم الأورام
من أنواع ابيضاض الدم
الأسباب
الأسباب عادة ما تكون ثانوية لانبثاث سرطاني في نخاع العظام
============
المآل ضعيف; معدل البقاء 15% على قيد الحياة في 6 أشهر
حالات مشابهة لوكيميا حادة، لمفوما، تفاعل ابيضاضي، خلايا غير ناضجة بسبب علاج كيميائي، بطانات غشائية منتشرة، خلايا نواء أو ناقضات العظم
ابيضاض الدم الليمفاوي المزمن (بالإنجليزية: Chronic Lymphocytic Leukemia) هو مرض سرطاني يصيب الخلية الليمفية من نوع B.
يصيب البالغين وخاصة الأفراد التي تتراوح أعمارهم ما بين 60- 80 عاما خاصة في أوروبا وأميركا الشمالية، وينتشر بين الذكور بنسبة أعلى من الإناث (1:2). يشكل ما نسبته 25% من الإصابات بمختلف أمراض أبيضاض الدم. في أميركا الشمالية، معدل الإصابة السنوي للرجال 3.35-3.69 لكل 000 100 شخص، أما بالنسبة للنساء هو 1.61-1.92 لكل 000 100 شخص. يتصف المرض بالتراكم التصاعدي للخلايا الليمفية في نخاع العظم والعقد الليمفية، وبالتالي انتقال المرض تدريجيا إلى بقية الأعضاء المصنعة للدم. يتم إيعاز المرض إلى خلل جزيئي يؤدي إلى تأخير أو إعطاب عملية استموات الخلايا.
أسباب المرض
بخلاف بقية أنواع أبيضاض الدم، لم يتم ربط الإصابة بالمرض مع عوامل مخطرة بيئية أو التعرض لأي مركبات كيميائية أو أشعة. أحد العوامل المخطرة المرض هو وجود إصابة بهذا المرض أو أية اضطرابات تكاثر ليمفي في أحد أفراد العائلة، وجد أن مصاب من كل 10 أشخاص مصابين بأبيضاض الدم الليمفي المزمن لديهم إصابة عائلية بالمرض.
الفسيولوجيا المرضية
وجد الباحثون أن من ميزات المرض هو تراكم وتكدس الخلايا الليمفية وليس من الانقسام الغير طبيعي للخلايا. ومن هنا تم ربط المرض بعملية استموات الخلايا. تتم عملية استموات الخلايا من خلال طريقين رئيسين هما الطريق الداخلي (ميتكوندريا) والطريق الخارجي (TNF). تتضمن عمليات نقل إشارة وتنشيط وتثبيط مركبات معينة تؤدي بالنهاية لتحفيز عملية استموات الخلايا.
في أبيضاض الدم الليمفي المزمن تتدخل عدة بروتينات في الطريقين الداخلي والخارجي مما يؤدي إلى تثبيط عملية استماتة الخلايا. مثل هذه البروتينات عائلة بي سي إل 2 و NF-KB و Akt. ووجد أيضا أن بعض الاضطرابات الوراثية الخلوية تؤدي إلى إخلال في عمل المورثة بي53 المسؤولة عن تثبيط الأورام.
الأعراض
معظم حالات اكتشاف المرض تتم بالصدفة من خلال الفحوصات الروتينية أو بسبب ظهور أعراض فقر الدم أو تضخم متماثل في الغدد الليمفاوية وخاصة التي تقع في منطقة العنق والإبط، تظهر 3/2 الحالات تضخم في الكبد أوالطحال. وتظهر بعض الحالات تضخم في اللوزتين وبعض الكدمات لقلة الصفائح الدموية.
العلامات المخبرية
تظهر الفحوصات المخبرية ارتفاع في أعداد كريات الدم البيضاء الليمفية ووجودها بما نسبته 40% أو أكثر في نخاع العظم. في صورة الدم، تظهر الخلايا بأحجام صغيرة وكمية السايتوبلازم تكون ضئيلة ولا تظهر النوية بشكل واضح.
يشاهد في صورة الدم خلايا تعرف باسم سلائف الليمفيات، وتكون كبيرة الحجم مقارنة بالكريات الليمفية ولا تزيد عن 5%. في بعض الحالات المرضية تشاهد بنسبة أعلى، في تلك الحالة يتم تشخيص الحالة كنوع من أنواع المرض ويسمى أبيضاض الدم الليمفي المزمن/سلائف الليمفيات.
فحص نقي العظم{{{{{{{فحص نخاع العظم
يشكل فحص نقي العظم أهمية كبيرة في عملية تشخيص المرض، ومتابعة العلاج. تكمن أهميته في النقاط التالية: وسيلة لتحديد مآل ومرحلة المرض: عندما يكون نخاع العظم مكدس بالخلايا الليمفية مع عديد قليل جدا من المناطق الدهنية (النمط المنتشر)، هذا يؤشر إلى أن المرض في مرحلة متأخرة وبالعادة يكون مآل المرض سيئ. وقد يكون نمط نخاع العظم خلالي مع وفرة المساحات الدهنية أو يكون نمط عقدي الشكل. بعض الإصابات تظهر مزيج من النمطين الأخيرين.
تحديد طبيعة ومسبب قلة الحُمُر والصفائح: يساعد فحص نخاع العظم على تحديد مسبب قلة الخلايا في الدم وبالتالي معالجة المسبب.
التشخيص التفريقي مع الأمراض الأخرى: يتم ملاحظة نمط ترشيح الخلايا الليمفية يساعد على تشخيص أبيضاض الدم الليمفي المزمن من بقية الأمراض التي تتشابه معه.
متابعة واستجابة المريض للعلاج.
مآل المرض
هناك عدة عوامل لها دور في تحديد مآل المرض.
عوامل محددة لمآل المرض
العامل جيد سيئ
مرحلة المرض بينت A راي (0-I) بينت B,C راي (II-IV)
الجنس انثى ذكر
مدة تضاعف الليمفيات بطيئ سريع
نمط خزعة نخاع العظم عقدي منتشر
الوراثة الخلوية حذف 13q4 حذف 17p، حذف 11q23، تثلث صبغي 12
مورثة VH مطفرة طبيعية
تعبير CD38 قليل مرتفع
تعبير ZAP-70 قليل مرتفع
أنظمة تحديد مرحلة المرضهنالك نظامان يستخدمان لتحديد مرحلة المرض، النظام الأول، نظام راي (1975)، قسمت مجموعة راي المرض لعدة مراحل:مرحلة 0: تتصف بارتفاع كريات الدم البيضاء الليمفاوية فقط
مرحلة I: تضخم في الغدد الليمفاوية
مرحلة II: تضخم في الكبد أو الطحال أو كلاهما
مرحلة III: فقر الدم
مرحلة IV: هبوط في الصفائح
النظام الآخر هو نظام بينت (1981).
طور بينت هذا النظام بالاعتماد على دراستين فرنسيتين. يتم تقسيم مراحل المرض بالاعتماد على عدد الأعضاء اللمفاوية المتضخمة (العنق والإبط والمنطقة الأربية والكبد والطحال) كالتالي: A: ارتفاع كريات الدم البيضاء الليمفاوية فقط مع عدم وجود أي تضخم أو تضخم عضوين أو أقل
B: تضخم 3 أعضاء أو أكثر
C: وجود فقر دم أوانخفاض في الصفائح الدموية
الوراثة الخلوية
أظهرت الأبحاث أن ما نسبته 80% على الأقل من حالات الإصابة بالمرض تحوي على اضطراب وراثي خلوي أو أكثر. يتم تشخيص هذه الاضطرابات بواسطة فحص التهجين الموضعي المتألق، لما لها من دور في تحديد مآل المرض. صدرت دراسة في عام 2000 قام بها دونر ومجموعته بدراسة 325 مريض وخرجوا بمجموعة من الاضطرابات الوراثية الخلوية ورتبوها حسب دورها في مآل المرض من السيئ إلى الجيد.
الاضطرابات الوراثية الخلوية حسب دراسة دونر مرتبة حسب دورها في مآل المرض
الاضطرابات الوراثية الخلوية نسبة الإصابة
حذف 17p 7%
حذف 11q 17%
تثلث صبغي 12 14%
نمط نووي طبيعي 18%
حذف 13q4 36%
غيرها 8%
مورثة VH
كان الاعتقاد السائد أن المرض يحدث في الخلايا الليمفية التي تحوي نسخة طبيعية من مورثة VH. إلا أنه اكتشف حديثا أن أكثر من نصف حالات المرضى (55%) يحملون مورثة VH مُطفّرة. تكمن أهمية حدوث هذه الطفرة لتعزز قدرة الخلايا الليمفية على إنتاج أضداد متخصصة. وجدت الدراسات أن الأشخاص الذين يحملون النسخة المطفرة من المورثة يكون مآل المرض أفضل من المرضى الذين يحملون النسخة الطبيعية. يتم التحري عن هذه الطفرة إما بقياس كميات CD38 في الخلايا الليمفية أو التحري عن التعبير الجيني لمورثة ZAP-70. كلاهما ينتج بكميات أكبر في حالة المورثة الطبيعية.
التشخيص التفريقي
تشتبه بعض الأمراض في الأعراض والظواهر مما تجعل مهمة التشخيص صعبة في بعض الأحيان مثل هذه الأمراض متلازمة ريختر وأبيضاض الدم الليمفي المزمن العائلي وكثرة الليمفيات البائية الوحيدة ومتعددة النسيلة.
تم تطوير نظام نقاط حتى يتم التفريق بين أبيضاض الدم الليمفي المزمن وغيره وذلك بالاعتماد على وجود بعض المؤشرات. هناك 5 مؤشرات يتم التحري عنها بواسطة جهاز عداد الخلايا. كل منها يشكل نقطة واحدة. تحسب النقاط بعدها ويتم تشخيص المرض بالاعتماد على تلك المؤشرات.
العلاج
تتم معالجة المرض بعدة طرق: العلاج الكيميائي: ويستخدم للقضاء على الخلايا السرطانية ومنعها من الانقسامز مثل كلورامبيوسيل (Chlorambucil) وفلودارابين (Fludarabine).
العلاج الإشعاعي: يتم تعريض المريض للأشعة العلاجية لتقليص حجم الغدد الليمفية والتي لا تستجيب للعلاج الكيميائي.
الأضداد وحيدة النسيلة: يتم استخدام الريتوكسيماب (Rituximab) للقضاء على الخلايا السرطانية.
زراعة نخاع العظم.
===
سرطانة خلايا الدم{{{{{من ويكيبيديا، الموسوعة الحرة
سرطانة خلايا الدم

حالة من سرطانة خلايا الدم. الخلايا المستديرة الكبيرة هي خلايا سرطان الثدي تنتشر في الدم المحيطي.
تسميات أخرى سرطانة خلايا اللوكيميا
معلومات عامة
الاختصاص علم الدم، علم الأورام
من أنواع ابيضاض الدم
الأسباب
الأسباب عادة ما تكون ثانوية لانبثاث سرطاني في نخاع العظام
============
المآل ضعيف; معدل البقاء 15% على قيد الحياة في 6 أشهر
حالات مشابهة لوكيميا حادة، لمفوما، تفاعل ابيضاضي، خلايا غير ناضجة بسبب علاج كيميائي، بطانات غشائية منتشرة، خلايا نواء أو ناقضات العظم
===========
سرطانة خلايا الدم (بالإنجليزية: Carcinocythemia) هي حالة تظهر فيها خلايا من الأورام الخبيثة ذات الأصل غير المكون للدم على شريحة دم المحيطية. وهي حالة نادرة للغاية حيث تم تحديد 33 حالة في الأدبيات العلمية من 1960 إلى 2018. تحدث سرطانة خلايا الدم عادةً نتيجة لتسلل انبثاث سرطاني لنخاع العظم وتكون إمكانية تشخيصها سيئة للغاية.
العرضتحدث سرطانة خلايا الدم في الغالب في حالات سرطان الثدي تليها سرطان الرئة ذو الخلايا الصغيرة وعادة ما تظهر متأخراً أثناء المرض. كثيرا ما يتم الإبلاغ عن تجلط الدم وتخثر الدم داخل الأوعية الدموية عند الإبلاغ عن سرطانة خلايا الدم. التشخيص في حالات سرطانة خلايا الدم ما زال ضعيفًا حيث وجدت مراجعة لـ 26 مريضا أن 85% منهم ماتوا خلال 6 أشهر من التشخيص بمتوسط 6.1 أسابيع بين التشخيص والموت.يمكن أن تتراوح كمية الخلايا السرطانية الموجودة على لطاخة الدم ما بين 1 إلى 80 بالمائة من إجمالي عدد خلايا الدم البيضاء مع كون النسب المئوية المنخفضة أكثر شيوعًا. تختلف سرطانة خلايا الدم عن وجود الخلايا السرطانيّة المنتشرة (CTCs) حيث عادة ما تحدث CTCs بكميات منخفضة بحيث لا يمكن رؤيتها في فحص لطاخة الدم مما يتطلب تقنيات خاصة للكشف.
الآليةآلية حدوث سرطانة خلايا الدم غير مفهومة بشكل جيد. يُظهر بعض المرضى الذين يعانون من سرطان الخلايا دليلًا على ضعف وظيفة الطحال وقد اقترح أن اختلالا وظيفيا في الجملة الشبكية البطانية يمنع بلعمة الخلايا الخبيثة يمكن أن يسهم في وجود سرطانة خلايا الدم.
التشخيصيمكن اكتشاف سرطانة خلايا الدم في فحص روتيني لشريحة دم أو التعداد اليدوي. إذا كان عدد الخلايا المشبوهة منخفضًا فيمكن تحضير اللطاخة من الطبقة العازلة لعينة الدم لتركيز الخلايا. قد تبدو الخلايا السرطانية في الدم المحيطي مماثلة للخلايا الأرومية المنتشرة أو خلايا الأورام اللمفاوية. تشمل الميزات التي تساعد في التمييز بين الخلايا السرطانية والخلايا الأخرى حجمها الكبير جدًا ونمط الكروماتين النووي الناضج والجِبْلة الفَجْوِيَّة وميلها إلى الظهور في كتل أو مجموعات على الرغم من أن بعض هذه الخصائص يتم مشاركتها بواسطة أرومات النواء وأرومات الوحيدة. غالبًا ما توجد خلايا الورم على حافة لطاخة الدم بسبب حجمها الكبير، لذلك يجب فحص هذه المنطقة جيدًا إذا كان هناك اشتباه في حدوث سرطانة خلايا الدم.يمكن أن تساعد تقنيات الصبغ الكيميائي الخلوي والكيمياء النسيجية المناعية في تحديد نسب الخلايا. عندما يتم فحص النمط الظاهري المناعي عن طريق قياس التدفق الخلوي تكون الخلايا بشكل عام CD45 سالبة وقد تعبر عن CD56 وهي حالة غير محددة ولكنها غير مألوف بالنسبة للأورام الخبيثة الدموية. في بعض الحالات قد تكون نتائج قياس التدفق الخلوي وFISH مضللين حيث إن الخلايا السرطانية المنتشرة يمكن أن تظهر عناقيد التمايز للخلايا وتشوهات الكروموسومات المرتبطة بأمراض الدم.يستخدم فحص نخاع العظم في الكشف عن سرطانة خلايا الدم لتوصيف الخلايا السرطانية بشكل أفضل.
التشخيص التفاضلييجب تمييز سرطانة خلايا الدم عن الحالات التالية:سرطان الدم الحاد
الخلايا المنتشرة غير الناضجة الثانوية للعلاج الكيميائي
خلايا البطانة الغشائية المنتشرة وخلايا نواء أو الخلايا ناقضة العظم
التَفاعُلٌ الابْيضاضِيّ
سرطان الغدد الليمفاوية
التاريخوُصف وجود الخلايا السرطانية في الدم المحيطي لمريض السرطان لأول مرة في تقرير حالة في عام 1869 في المجلة الطبية الأسترالية. استخدم مصطلح carcinocythemia (سرطانة خلايا الدم) لأول مرة في عام 1976 من قبل روبرت كاري. وفي عام 1984 تم نشر مراجعة لـ 10 حالات مع ملاحظة سوء الحالة المرضية.
في الحيواناتهناك حالتان موثقتان اعتبارًا من عام 2018 بإصابتها بسرطانة خلايا الدم في الكلاب وحالة واحدة في القطط.
انظر أيضًاسرطانة الخلية الكلوية
ابيضاض الدم
=====
مرض دموي{{{{{{من ويكيبيديا، الموسوعة الحرة
مرض دموي
معلومات عامة
الاختصاص علم الدم
من أنواع عرض، ومرض لكيان تشريحي
الموقع التشريحي جملة مكونة
أدوية{{{{{{{{بريدنيزولون، وديكساميتازون، وبريدنيزون، وميثيلبريدنيزولون، وروكسوليتينيب، وريفاروكسابان
سرطانة خلايا الدم (بالإنجليزية: Carcinocythemia) هي حالة تظهر فيها خلايا من الأورام الخبيثة ذات الأصل غير المكون للدم على شريحة دم المحيطية. وهي حالة نادرة للغاية حيث تم تحديد 33 حالة في الأدبيات العلمية من 1960 إلى 2018. تحدث سرطانة خلايا الدم عادةً نتيجة لتسلل انبثاث سرطاني لنخاع العظم وتكون إمكانية تشخيصها سيئة للغاية.
العرضتحدث سرطانة خلايا الدم في الغالب في حالات سرطان الثدي تليها سرطان الرئة ذو الخلايا الصغيرة وعادة ما تظهر متأخراً أثناء المرض. كثيرا ما يتم الإبلاغ عن تجلط الدم وتخثر الدم داخل الأوعية الدموية عند الإبلاغ عن سرطانة خلايا الدم. التشخيص في حالات سرطانة خلايا الدم ما زال ضعيفًا حيث وجدت مراجعة لـ 26 مريضا أن 85% منهم ماتوا خلال 6 أشهر من التشخيص بمتوسط 6.1 أسابيع بين التشخيص والموت.يمكن أن تتراوح كمية الخلايا السرطانية الموجودة على لطاخة الدم ما بين 1 إلى 80 بالمائة من إجمالي عدد خلايا الدم البيضاء مع كون النسب المئوية المنخفضة أكثر شيوعًا. تختلف سرطانة خلايا الدم عن وجود الخلايا السرطانيّة المنتشرة (CTCs) حيث عادة ما تحدث CTCs بكميات منخفضة بحيث لا يمكن رؤيتها في فحص لطاخة الدم مما يتطلب تقنيات خاصة للكشف.
الآليةآلية حدوث سرطانة خلايا الدم غير مفهومة بشكل جيد. يُظهر بعض المرضى الذين يعانون من سرطان الخلايا دليلًا على ضعف وظيفة الطحال وقد اقترح أن اختلالا وظيفيا في الجملة الشبكية البطانية يمنع بلعمة الخلايا الخبيثة يمكن أن يسهم في وجود سرطانة خلايا الدم.
التشخيصيمكن اكتشاف سرطانة خلايا الدم في فحص روتيني لشريحة دم أو التعداد اليدوي. إذا كان عدد الخلايا المشبوهة منخفضًا فيمكن تحضير اللطاخة من الطبقة العازلة لعينة الدم لتركيز الخلايا. قد تبدو الخلايا السرطانية في الدم المحيطي مماثلة للخلايا الأرومية المنتشرة أو خلايا الأورام اللمفاوية. تشمل الميزات التي تساعد في التمييز بين الخلايا السرطانية والخلايا الأخرى حجمها الكبير جدًا ونمط الكروماتين النووي الناضج والجِبْلة الفَجْوِيَّة وميلها إلى الظهور في كتل أو مجموعات على الرغم من أن بعض هذه الخصائص يتم مشاركتها بواسطة أرومات النواء وأرومات الوحيدة. غالبًا ما توجد خلايا الورم على حافة لطاخة الدم بسبب حجمها الكبير، لذلك يجب فحص هذه المنطقة جيدًا إذا كان هناك اشتباه في حدوث سرطانة خلايا الدم.يمكن أن تساعد تقنيات الصبغ الكيميائي الخلوي والكيمياء النسيجية المناعية في تحديد نسب الخلايا. عندما يتم فحص النمط الظاهري المناعي عن طريق قياس التدفق الخلوي تكون الخلايا بشكل عام CD45 سالبة وقد تعبر عن CD56 وهي حالة غير محددة ولكنها غير مألوف بالنسبة للأورام الخبيثة الدموية. في بعض الحالات قد تكون نتائج قياس التدفق الخلوي وFISH مضللين حيث إن الخلايا السرطانية المنتشرة يمكن أن تظهر عناقيد التمايز للخلايا وتشوهات الكروموسومات المرتبطة بأمراض الدم.يستخدم فحص نخاع العظم في الكشف عن سرطانة خلايا الدم لتوصيف الخلايا السرطانية بشكل أفضل.
التشخيص التفاضلييجب تمييز سرطانة خلايا الدم عن الحالات التالية:سرطان الدم الحاد
الخلايا المنتشرة غير الناضجة الثانوية للعلاج الكيميائي
خلايا البطانة الغشائية المنتشرة وخلايا نواء أو الخلايا ناقضة العظم
التَفاعُلٌ الابْيضاضِيّ
سرطان الغدد الليمفاوية
التاريخوُصف وجود الخلايا السرطانية في الدم المحيطي لمريض السرطان لأول مرة في تقرير حالة في عام 1869 في المجلة الطبية الأسترالية. استخدم مصطلح carcinocythemia (سرطانة خلايا الدم) لأول مرة في عام 1976 من قبل روبرت كاري. وفي عام 1984 تم نشر مراجعة لـ 10 حالات مع ملاحظة سوء الحالة المرضية.
في الحيواناتهناك حالتان موثقتان اعتبارًا من عام 2018 بإصابتها بسرطانة خلايا الدم في الكلاب وحالة واحدة في القطط.
انظر أيضًاسرطانة الخلية الكلوية
ابيضاض الدم
=====
مرض دموي{{{{{{من ويكيبيديا، الموسوعة الحرة
مرض دموي
معلومات عامة
الاختصاص علم الدم
من أنواع عرض، ومرض لكيان تشريحي
الموقع التشريحي جملة مكونة
أدوية{{{{{{{{بريدنيزولون، وديكساميتازون، وبريدنيزون، وميثيلبريدنيزولون، وروكسوليتينيب، وريفاروكسابان
==========
الأمراض الدموية عبارة عن اعتلالات تصيب الدم.
علم أمراض الدم يتضمن دراسة هذه الأمراض.
الاعتلالات النخاعيةاعتلالات الهيموغلوبين (عيب خلقي في جزئ الهيموغلوبين أو في معدل تصنيعه) فقر الدم المنجلي

الكريات الحمراء الطبيعية مقارنةً بكريات الدم منجلية الشكل في فقر الدم المنجلي ثلاسيميا
ميتهيموغلوبينيَّة الدَّم
فقر الدم (نقص كرات الدم الحمراء أو الهيموغلوبين) فقر الدم الناجم عن عوز الحديد
فقر الدم الضخم الأرومات نقص فيتامين ب 12 فقر الدم الخبيث
نقص حمض الفوليك
فقر الدم الانحلالي (تكسير كريات الدم الحمراء) اعتلالات جينية في جدار الكريات الحمراء كَثْرَةُ الكُرَيَّاتِ الإِهْليلَجِيَّة الوِراثِيَّة
كَثْرَةُ الكُرَيَّاتِ الحُمْر الكُرَوِيَّة الوِراثِيَّة
فقر الدم بخلل تكون الكريات الحمر الخلقي
اعتلالات جينية في أيض الكريات الحمراء أنيميا الفول
نقص كينازُ البيروفات
فقر الدم الانحلالي المناعي فقر الدم الانحلالي بالمناعة الذاتية فقر الدم الانحلالي المناعي الذاتي المرتبط بالأضداد الحارة
مجهول السبب
الذئبة الحمراء
متلازمة إيفان (أجسام مضادة مُضادٌّة للصُّفَيحات)
فقر الدم الانحلالي المناعي الذاتي المرتبط بالأضداد الباردة كثرة الوحيدات العدوائية
البيلة الهيموغلوبينية البردية الانتيابية.
فقر الدم الانحلالي الناتج عن المناعة المتباينة انحلال الدم الوليدي
فَقْرُ الدَّمِ الانحلالي المناعي المحدث بالأَدْوِيَة البنسلين
المثيلدوبا
اعتلالات الهيموغلوبين (حيث يكون الهيموغلوبين في تلك الحالة غير مستقر أو متبلور)
البيلة الهيموغلوبينية الانتيابية الليلية (خلل نادر في البروتينات الموجودة على سطح الكريات الحمراء)
ضرر مباشر على الكريات الحمراء فقر الدم الانحلالي باعتلال الأوعية الدقيقة
نتيجة لصمامات القلب الاصطناعية
فقر الدم اللاتنسجي أنيميا فانكوني
فقر دم دياموند-بلاكفان
فقر الدم الاتنسجي المكتسب الناتج عن فقد طلائع الكريات الحمراء
نقص عدد الخلايا متلازمة خلل التنسج النقوي
التليف النقوي
قلة الخلايا المتعادلة
ندرة المحببات
وهن الصفيحات جلانزمان
قلة الصفيحات الفرفرية قليلة الصفيحات مجهولة السبب
لفُرْفُرِيَّةُ القَليلَةُ الصُّفَيحاتِ الخُثارِيَّة
قلة الصفيحات المحدثة بالهيبارين
مرض التكاثر النقوي زيادة أعداد الخلايا كثرة الحمر الحقيقية
كثرة كريات الدم الحمر
كثرة الكريات البيض
كثرة الصفيحات
مرض التكاثر النقوي
اعتلالات خثرية كَثْرَةُ الصُّفَيحات
التخثر المتكرر
لتَّخَثُّرُ المُنْتَثِرُ داخِلَ الأَوعِيَة
اعتلالات بروتنيات التجلط الهيموفيليا أو الناعور
مرض فون ويليبراند
التخثر المنتشر داخل الأوعية
متلازمة أضداد الفوسفوليبيد
اعنلالات الضفيحات
الأورام الخبيثة الدمويةلمفوما لمفوما هودجكين

صورة لطفل مصاب بلمفوما هودجكين لمفوما لاهودجكينية لمفوما بيركت

طفل نيجيري يبلغ 7 أعوام من العمر مثاب بلمفوما بيركت ورم الخلايا الكبيرة المتحولة الليمفاوي
لمفوما المنطقة الهامشية الطحالية
الورم النقوي الورم المقوي المتعدد
مرض فالدنشتروم
ورم البلازماويات
ابيضاض الدم ابيضاض الدم الليمفاوي الحاد
ابيضاض الدم الليمفاوي المزمن
ابيضاض الدم النقوي الحاد
ابيضاض الدم النقوي المزمن
أبْيِضاضُ العَدِلاَت المزمن
الأبْيِضاضُ المُشَعَّرُ الخَلاَيا
متفرقاتداء ترسب الأصبغة الدموية أو التحميل المفرط بالحديد
انعدام الطحال
فرط نشاط الطحال داء غوشيه
داء البلعمة
اعْتِلاَلٌ غامَّائِيّ أُحادِيُّ النَّسِيْلَة ذو أهمية غير محددة.
تغيرات دموية نتيجة اعتلالات غير دمويةفقر دم الأمراض المزمنة
كثرة الوحيدات العدوائية

تضخم العقد الليمفاوية في شخص مصاب بداء كثرة الوحيدات العدوائية الإيدز
الملاريا
داء الليشمانيات
===={{{{{{{من ويكيبيديا، الموسوعة الحرة
لمفوما

معلومات عامة
الاختصاص علم الدم، وعلم الأورام
من أنواع سرطان دموي
، وسرطان الجهاز اللمفاوي
أدوية{{{{{أسباراجينيز /وميثوتركسيت، وميتوكسانترون، وسيتارابين، وإيتوبوسيد، وإرينوتيكان، وثيوتيبا، ومكلورثامين، وبينداميوستين، ونيفولوماب، وليناليدوميد، وريتوكسيماب، وبيغفيلغراستيم، وإبروتينيب+ وإفروليموس، وجيمسيتابين، وبرنتوكسيماب فيدوتين، وديكساميتازون، وفينكريستين، وبريدنيزولون، ودوكسوروبيسين، وبروكاربازين
الأمراض الدموية عبارة عن اعتلالات تصيب الدم.
علم أمراض الدم يتضمن دراسة هذه الأمراض.
الاعتلالات النخاعيةاعتلالات الهيموغلوبين (عيب خلقي في جزئ الهيموغلوبين أو في معدل تصنيعه) فقر الدم المنجلي

الكريات الحمراء الطبيعية مقارنةً بكريات الدم منجلية الشكل في فقر الدم المنجلي ثلاسيميا
ميتهيموغلوبينيَّة الدَّم
فقر الدم (نقص كرات الدم الحمراء أو الهيموغلوبين) فقر الدم الناجم عن عوز الحديد
فقر الدم الضخم الأرومات نقص فيتامين ب 12 فقر الدم الخبيث
نقص حمض الفوليك
فقر الدم الانحلالي (تكسير كريات الدم الحمراء) اعتلالات جينية في جدار الكريات الحمراء كَثْرَةُ الكُرَيَّاتِ الإِهْليلَجِيَّة الوِراثِيَّة
كَثْرَةُ الكُرَيَّاتِ الحُمْر الكُرَوِيَّة الوِراثِيَّة
فقر الدم بخلل تكون الكريات الحمر الخلقي
اعتلالات جينية في أيض الكريات الحمراء أنيميا الفول
نقص كينازُ البيروفات
فقر الدم الانحلالي المناعي فقر الدم الانحلالي بالمناعة الذاتية فقر الدم الانحلالي المناعي الذاتي المرتبط بالأضداد الحارة
مجهول السبب
الذئبة الحمراء
متلازمة إيفان (أجسام مضادة مُضادٌّة للصُّفَيحات)
فقر الدم الانحلالي المناعي الذاتي المرتبط بالأضداد الباردة كثرة الوحيدات العدوائية
البيلة الهيموغلوبينية البردية الانتيابية.
فقر الدم الانحلالي الناتج عن المناعة المتباينة انحلال الدم الوليدي
فَقْرُ الدَّمِ الانحلالي المناعي المحدث بالأَدْوِيَة البنسلين
المثيلدوبا
اعتلالات الهيموغلوبين (حيث يكون الهيموغلوبين في تلك الحالة غير مستقر أو متبلور)
البيلة الهيموغلوبينية الانتيابية الليلية (خلل نادر في البروتينات الموجودة على سطح الكريات الحمراء)
ضرر مباشر على الكريات الحمراء فقر الدم الانحلالي باعتلال الأوعية الدقيقة
نتيجة لصمامات القلب الاصطناعية
فقر الدم اللاتنسجي أنيميا فانكوني
فقر دم دياموند-بلاكفان
فقر الدم الاتنسجي المكتسب الناتج عن فقد طلائع الكريات الحمراء
نقص عدد الخلايا متلازمة خلل التنسج النقوي
التليف النقوي
قلة الخلايا المتعادلة
ندرة المحببات
وهن الصفيحات جلانزمان
قلة الصفيحات الفرفرية قليلة الصفيحات مجهولة السبب
لفُرْفُرِيَّةُ القَليلَةُ الصُّفَيحاتِ الخُثارِيَّة
قلة الصفيحات المحدثة بالهيبارين
مرض التكاثر النقوي زيادة أعداد الخلايا كثرة الحمر الحقيقية
كثرة كريات الدم الحمر
كثرة الكريات البيض
كثرة الصفيحات
مرض التكاثر النقوي
اعتلالات خثرية كَثْرَةُ الصُّفَيحات
التخثر المتكرر
لتَّخَثُّرُ المُنْتَثِرُ داخِلَ الأَوعِيَة
اعتلالات بروتنيات التجلط الهيموفيليا أو الناعور
مرض فون ويليبراند
التخثر المنتشر داخل الأوعية
متلازمة أضداد الفوسفوليبيد
اعنلالات الضفيحات
الأورام الخبيثة الدمويةلمفوما لمفوما هودجكين

صورة لطفل مصاب بلمفوما هودجكين لمفوما لاهودجكينية لمفوما بيركت

طفل نيجيري يبلغ 7 أعوام من العمر مثاب بلمفوما بيركت ورم الخلايا الكبيرة المتحولة الليمفاوي
لمفوما المنطقة الهامشية الطحالية
الورم النقوي الورم المقوي المتعدد
مرض فالدنشتروم
ورم البلازماويات
ابيضاض الدم ابيضاض الدم الليمفاوي الحاد
ابيضاض الدم الليمفاوي المزمن
ابيضاض الدم النقوي الحاد
ابيضاض الدم النقوي المزمن
أبْيِضاضُ العَدِلاَت المزمن
الأبْيِضاضُ المُشَعَّرُ الخَلاَيا
متفرقاتداء ترسب الأصبغة الدموية أو التحميل المفرط بالحديد
انعدام الطحال
فرط نشاط الطحال داء غوشيه
داء البلعمة
اعْتِلاَلٌ غامَّائِيّ أُحادِيُّ النَّسِيْلَة ذو أهمية غير محددة.
تغيرات دموية نتيجة اعتلالات غير دمويةفقر دم الأمراض المزمنة
كثرة الوحيدات العدوائية

تضخم العقد الليمفاوية في شخص مصاب بداء كثرة الوحيدات العدوائية الإيدز
الملاريا
داء الليشمانيات
===={{{{{{{من ويكيبيديا، الموسوعة الحرة
لمفوما

معلومات عامة
الاختصاص علم الدم، وعلم الأورام
من أنواع سرطان دموي
، وسرطان الجهاز اللمفاوي
أدوية{{{{{أسباراجينيز /وميثوتركسيت، وميتوكسانترون، وسيتارابين، وإيتوبوسيد، وإرينوتيكان، وثيوتيبا، ومكلورثامين، وبينداميوستين، ونيفولوماب، وليناليدوميد، وريتوكسيماب، وبيغفيلغراستيم، وإبروتينيب+ وإفروليموس، وجيمسيتابين، وبرنتوكسيماب فيدوتين، وديكساميتازون، وفينكريستين، وبريدنيزولون، ودوكسوروبيسين، وبروكاربازين
========
سرطان الغدد الليمفاوية أو ورم الغدد اللمفاوية أو اللمفوما أو اللِمفُومة (بالإنجليزية: Lymphoma) هو مجموعة أورام خلايا الدم التي تنشأ من (الخلايا اللمفاوية) الموجودة في الجهاز اللمفاوي حيث تشكل هذه الخلايا ما يعرف بالشبكة البطانية، وكثيرًا ما يشير هذا الاسم إلى الأنواع السرطانية من هذه الأورام. وتشمل العلامات والأعراض المُصاحبة لهذا المرض، تضخم العقد الليمفاوية، والحمى، والتعرق الغزير خاصة بالليل، بالإضافة إلى فقدان الوزن، والحكة، والشعور بالتعب. وعادة ما تكون الغدد الليمفاوية المتضخمة غير مؤلمة.هناك العشرات من الأنواع الفرعية من الأورام اللمفاوية، ولكن النوعين الرئيسيين هما لمفومة هودجكين واللمفومة اللاهودجكينية والتي تُعد أكثر خطورة من لمفومة هودجكين. تضم منظمة الصحة العالمية فئتين غيرهما من أنواع سرطان الغدد الليمفاوية: الورم النخاعي المتعدد والأمراض المناعية التكاثرية. وحوالي 90٪ من الأورام اللمفاوية من نوع اللمفومة اللاهودجكينية، ويُعتبر سرطان الغدد الليمفاوية وابيضاض الدم جزء من مجموعة أوسع من أورام الأنسجة المكونة للدم والنسيج الليمفاوي.هُناك عدة عوامل خطرة للمفومة هودجكين، وتشمل: العدوى بفيروس إبشتاين بار وتاريخ مرضي للأسرة من قبل. أما عوامل الخطر للمفومة اللاهودجكينية فتشمل: أمراض المناعة الذاتية، وفيروس نقص المناعة البشرية/الإيدز، والأدوية المثبطة للمناعة، وبعض المبيدات الحشرية، وقد يؤدي تناول كميات كبيرة من اللحوم الحمراء إلى زيادة خطر الإصابة بالمرض.وعادةً ما يكون التشخيص في حالة تضخم العقد اللمفاوية عن طريق أخذ خزعة من العقدة الليمفاوية المتضخمة، وأيضًا عن طريق اختبارات الدم والبول وفحص نخاع العظم، وقد تكون مفيدة في التشخيص. وغالبًا ما ينتشر سرطان الغدد الليمفاوية إلى الرئتين، وَالكبد، و/أو الدماغ. وقد يشمل العلاج واحدا أو أكثر من الإجراءات التالية: العلاج الكيميائي، العلاج الإشعاعي، والعلاج الموجه والجراحة، وفي بعض الأورام اللمفاوية اللاهودجكينية، فإن زيادة كمية البروتين التي تنتجها خلايا الليمفوما تتسبب في جعل الدم سميكًا فيتم فصل البلازما لإزالة البروتين، وتعتمد النتائج على نوع السرطان الليمفاوي وقابليته للشفاء. أما بالنسبة لمعدل البقاء على قيد الحياة فيصل إلى خمس سنوات في الولايات المتحدة ولجميع أنواع سرطان الغدد الليمفاوية هو 85٪، في حين أن المعدل للورم اللاهودجكيني هو 69٪. في عام 2012؛ أُصيب بالليمفوما 566,000 وتسببت في 305,000 حالة وفاة. تشكّل الليمفوما 3-4٪ من جميع حالات السرطان، مما يجعلها المجموعة السابعة الأكثر شيوعًا. بينما في الأطفال، هي السرطان الثالث الأكثر شيوعاً. وفي كثير من الأحيان؛ تحدث في الدول المتقدمة أكثر من دول العالم النامي.
أنواع اللمفومالمفوما هودجيكنية نسبتها 15% من مجموع اللمفومات، وأنواعها: هودجكين تصلب عقدي (الأكثر انتشارًا في البالغين).
هودجكين مختلط الخلايا (الأكثر انتشارًا عند الأطفال).
هودجكين غنية بالخلايا اللمفاوية (أفضل الأنواع).
هودجكين فقيرة الخلايا اللمفاوية (الأسوأ والأخطر). لمفوما لاهودجكينية نسبتها 85% من مجموع اللمفومات، وتنقسم إلى: لاهودجكنية في الخلايا اللمفية البائية B، نسبتها 85%
لاهودجكنية في الخلايا اللمفية التائية T، نسبتها 15%
أسباب اللمفوما وعوامل الخطورة
العمر - معظم الأورام اللمفاوية تصيب الأشخاص أكثر من 60 سنة.
العِرق - في الولايات المتحدة، الأمريكيون من أصل أفريقي والأميركيون الآسيويون يكونون أقل عرضة من الأميركيين البيض، كما أن المرض أكثر شيوعًا في دول العالم المتقدم.
المواد الكيميائية والإشعاعية - تم ربط بعض المواد الكيميائية المستخدمة في الزراعة مثل المبيدات الحشرية والبنزين، وكذلك التعرض للإشعاع النووي بالإصابة بالمرض، وأيضًا بعض صبغات الشعر خاصةً المُستخدَمة قبل عام 1980.
نقص المناعة - على سبيل المثال، الإصابة بفيروس نقص المناعة البشرية أو في زرع الأعضاء.
أمراض المناعة الذاتية، والتي يهاجم فيها الجهاز المناعي خلايا الجسم نفسه.
العدوى - بعض الالتهابات الفيروسية والبكتيرية تزيد من مخاطر الإصابة. مثل العدوى ببكتيريا هيليكوباكتر، أو فيروس إبشتاين بار (الفيروس الذي يسبب الحمى الغدية) والتهاب الكبد الفيروسي.
الوراثة - وجود تاريخ عائلي لسرطان الغدد الليمفاوية.
الأعراض والعلامات

الغدد الليمفاوية الأكثر عرضة للإصابة بالسرطان
قد يظهر سرطان الغدد الليمفاوية مع بعض الأعراض غير المحددة. فإذا كانت الأعراض مستمرة، يجب الفحص والتقييم لتحديد الأسباب، ومن بينها سرطان الغدد الليمفاوية. تورم الغدد الليمفاوية، هو العرض الرئيسي في سرطان الغدد الليمفاوية.أعراض من الصنف ب (الأعراض الجهازية)، يمكن أن تترافق مع كل من الليمفوما الهودجكينية واللاهودجكينية، وهي: حمى مجهولة السببتعرق ليليفقدان الوزن
وأعراض أخرى: فقدان الشهيةالتعب والإعياءضيق التنفس الحكة
التشخيص
الجهاز الليمفاوي وسرطان الغدد الليمفاوية
يتم التشخيص النهائي لسرطان الغدد الليمفاوية عن طريق أخذ خزعة من العقدة الليمفاوية، وهذا يعني الاستئصال الجزئي أو الكلي للعقدة الليمفاوية التي فُحِصَت تحت المجهر.
هذا الفحص يكشف المظاهر التشريحية المرضية التي قد تشير إلى سرطان الغدد الليمفاوية. وبعد تشخيص سرطان الغدد الليمفاوية، يمكن تنفيذ مجموعة مختلفة من الاختبارات لتحديد الأنواع المختلفة من سرطان الغدد الليمفاوية. مثل: الاختبار المناعي وقياس التدفق الخلوي والتهجين الموضعي المتألق.
التصنيف
ليمفوما هودجكين موضحة باستخدام صبغة الهيماتوكسيلين والإيوسين
الليمفوما بالمعنى الضيق هي الأورام الخبيثة من الخلايا الليمفاوية، وهو نوع من خلايا الدم البيضاء التي تنتمي إلى كل من الليمف والدم.
لذا، الليمفوما واللوكيميا هي أورام الخلايا المكوّنة للدم والأنسجة الليمفاوية. يؤثر التصنيف على العلاج وعلى تقدم المرض، وقد وُجدت عدة أنظمة لتصنيف سرطان الغدد الليمفاوية، والتي تستخدم النتائج التشريحية لتقسيم سرطان الغدد الليمفاوية إلى فئات مختلفة. عادة ما يتم التصنيف وفقًا لما يلي: ما إذا كان سرطان الغدد الليمفاوية من النوع هودجكين أم لا.
نشأ السرطان في الخلايا الليمفاوية من النوع B أو T.
موقع الخلايا السرطانية بالجسم.
ليمفوما هودجكين
المقالة الرئيسة: لمفوما هودجكين
سرطان الغدد الليمفاوية النوع هودجكين هو واحد من أكثر الأنواع المعروفة لسرطان الغدد الليمفاوية، ويختلف عن غيره من أشكال سرطان الغدد الليمفاوية في تقدم المرض والعديد من الخصائص المرضية. ويتميز هذا النوع بوجود نوع من الخلايا تسمى خلايا ريد-ستيرنبرغ.
الأورام الليمفاوية لاهودجكين
المقالة الرئيسة: لمفوما لاهودجكينية
الأورام اللمفاوية لاهودجكين، والتي تعرف بأنها كل الأورام اللمفاوية عدا ليمفوما هودجكين، وهي أكثر شيوعًا من النوع هودجكين. تضم هذه الفئة مجموعة واسعة من الأورام اللمفاوية، تختلف أسباب وأنواع الخلايا المصابة، وتقدم المرض باختلاف النوع. وتزيد احتمالات الإصابة بسرطان الغدد الليمفاوية لاهودجكين مع التقدم في السن. وتنقسم كذلك إلى عدة أنواع فرعية.
تصنيف منظمة الصحة العالميةيستند تصنيف منظمة الصحة العالمية، والذي نُشر عام 2001 وجرى تحديثه في عام 2008،
على الأسس التي وُضعت ضمن «التصنيف الأوروبي الأمريكي لسرطان الغدد الليمفاوية» (REAL). يصنّف هذا النظام الليمفوما حسب نوع الخلايا والمظهر المحدّد، أو الخصائص الوراثية الخلوية.
بعض أنواع سرطان الغدد الليمفاوية بطيئة؛ أي أنها متوافقة مع حياة طويلة حتى بدون علاج، في حين أن هناك أشكال أخرى عدوانية (مثل لمفوما بيركيت)، تتسبب في التدهور السريع والموت. لكن بشكل عام معظم الأورام اللمفاوية حتى العدوانية تستجيب جيدًا للعلاج وقابلة للشفاء. يعتمد تقدم المرض على التشخيص وتصنيف المرض الصحيحين.
تصنيفات قديمة

سرطان الغدد الليمفاوية، لاحظ المعالم غير المنتظمة للنواة كما تُظهر الخلايا CD5 ،CD20 والسيكلين D1 بصبغة الهيماتوكسيلين والإيوسين
اُستخدمت العديد من التصنيفات السابقة، بما في ذلك رابابورت 1956، كييل 1974، وREAL 1994. وكانت تلك التصنيفات تستبعد لمفوما هودجكين وتقسم الأورام اللمفاوية المتبقية إلى أربع درجات (منخفضة، متوسطة، عالية، والمتنوعة) اعتمادًا على تقدم المرض، مع بعض التقسيمات الفرعية على أساس حجم وشكل الخلايا المصابة. ولكن لم تشمل هذه التصنيفات أي معلومات حول علامات سطح الخلية، أو علم الوراثة، ولم تضع أي تمييز بين الأورام اللمفاوية في الخلايا T والأورام اللمفاوية في الخلايا B. كانت من قبل مقبولة على نطاق واسع، أما الآن فلم تعد تُستخدم. إلا من قِبل بعض وكالات السرطان لجمع الإحصاءات عن سرطان الغدد الليمفاوية والمقارنات التاريخية.
مراحل المرض
بعد التشخيص وقبل العلاج، يجب معرفة مرحلة المرض والتي تحدد ما إذا كان السرطان لازال في مكانٍ محدد أم انتشر إلى أماكن بعيدة.
يُسْتَخْدَم نظام التصنيف آن أربور بشكل روتيني لتنظيم كل من الليمفوما الهودجكينية واللاهودجكينية. في هذا النظام المتدرج، تمثل المرحلة الأولى أن المرض محدد في واحدة من العقد الليمفاوية، والثانية تمثل وجود سرطان الغدد الليمفاوية في اثنين أو أكثر من الغدد الليمفاوية، والثالثة تمثل انتشار سرطان الغدد الليمفاوية على جانبي الحجاب الحاجز، والرابعة تشير إلى انتشار المرض للأنسجة الأخرى غير العقد الليمفاوية.
تُستخدم الأشعة المقطعية أو التصوير بالمسح الضوئي PET لتحديد مرحلة السرطان.
العلاجيختلف العلاج باختلاف أنواع سرطان الغدد الليمفاوية،
ويعتمد أيضًا على درجة الورم، إشارةً إلى سرعة تكاثره، وعلى عكس المتوقع؛ الليمفوما الأعلى درجة تُعَالَج بسهولة أكبر ويكون تقدم المرض أفضل: مثل ليمفوما بيركيت وهو ورم عالي الدرجة معروف أنه يتضاعف في غضون أيام، رغم ذلك استجابته جيدة للغاية للعلاج. الأورام اللمفاوية تكون قابلة للشفاء إذا اُكْتُشِفَت في مراحل مبكرة مع توافر طرق العلاج الحديثة.
الليمفوما منخفضة الدرجة
سرطان الغدد الليمفاوية هودجكين، النوع الذي تسود فيه الخلايا الليمفاوية العقدية. لاحظ تكوين العقد الليمفاوية ومناطق التبقيع (صبغة الهيماتوكسيلين والإيوسين)
تظل العديد من الأورام اللمفاوية منخفضة الدرجة بطيئة لسنوات عديدة. وغالبًا ما نتجنب العلاج للمريض الذي لا تظهر عليه أعراض، نكتفي فقط بالانتظار والمتابعة. وذلك لأن الأضرار والمخاطر الناتجة عن العلاج تفوق الفوائد. أما عند ظهور الأعراض فيكون العلاج الإشعاعي أو العلاج الكيميائي هما الاختيار؛ على الرغم من أنها ليست علاجا نهائيا لسرطان الغدد الليمفاوية، وإنما يمكن أن تخفف الأعراض، لا سيما تضخم العقد اللمفاوية. المرضى الذين يعانون من هذه الأنواع من سرطان الغدد الليمفاوية يمكن أن يعيشوا أعمارًا شبه طبيعية، ولكن بدون شفاء من المرض. هناك دعوات لاستخدام ريتوكسيماب في علاج سرطان الغدد الليمفاوية بدلا من الانتظار والمتابعة تجنبًا للقلق الشديد لدى المرضى.
الليمفوما عالية الدرجة

توضيح للأماكن الأكثر عرضة لانتشار سرطان الغدد الليمفاوية: المخ والكبد والعظام.
يمكن أيضًا علاج بعض الأنواع الأخرى الأكثر شراسة في معظم الحالات، ولكن تدهور الحالة للمرضى ضعيفي الاستجابة للعلاج يكون سريعًا وسيئًا جدا، لذا يكون العلاج عادةً علاج كيميائي أقوى، بما في ذلك CHOP أو R-CHOP. تحدث معظم حالات الانتكاس في العامين الأولين، ثم يقل خطر الانتكاس بشكل ملحوظ بعد ذلك. وفي هذه الحالة يكون العلاج الكيميائي بجرعة عالية يليه زرع ذاتي للخلايا الجذعية.
علاج ليمفوما هودجكين
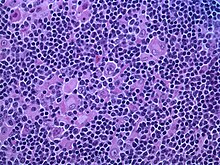
سرطان الغدد الليمفاوية، النوع الذي تسود فيه الخلايا الليمفاوية: لاحظ وجود خلايا L & H، التي تعرف أيضا باسم "خلايا الفشار". (صبغة الهيماتوكسيلين والإيوسين)
عادة ما يتم علاج ليمفوما هودجكين بالعلاج الإشعاعي وحده، طالما لم ينتشر السرطان.بينما مرض هودجكين المتقدم يتطلب نظامًا من العلاج الكيميائي، مترافقًا مع العلاج الإشعاعي في بعض الأحيان. ويشمل العلاج الكيميائي المستخدم: نظام أيه بي في دي (علاج)، والذي يُستخدم عادة في الولايات المتحدة. ومن النظم الأخرى المستخدمة في علاج ليمفوما هودجكين BEACOPP وكلاهما نُظُم فعّآلة، ولكن BEACOPP يكون أكثر سُميّة إلى جانب استعمال السنانفورد V. لايزال من الممكن إنقاذ عدد كبير من الناس الذين ينتكسون بعد نظام ABVD عن طريق زرع الخلايا الجذعية.
الرعاية المسكّنةالرعاية المسكّنة، هي رعاية طبية متخصصة تركز على الأعراض، والآلام، والقلق الناتج عن الإصابة بمرض خطير، فهي مفيدة لمعالجة كل من الأعراض المباشرة لسرطان الغدد الليمفاوية والعديد من الآثار الجانبية التي تنشأ من العلاج. تكون مفيدة بشكل خاص للأطفال، حيث تساعد كل من الأطفال وعائلاتهم على التعامل مع الأعراض الجسدية والنفسية لهذا المرض. وأيضًا لها أهمية خاصة للمرضى الذين يحتاجون زرع نخاع العظام.
تقدُّم المرض
معدل البقاء على قيد الحياة لمدة خمس سنوات وِفقًا للمرحلة التشخيصية
المرحلة التشخيصية معدل البقاء على قيد الحياة لمدة خمس سنوات (%) النسبة المئوية للحالات (%)
محدد في الموقع الأوّلي للسرطان 82.3 26
انتشر إلى العقد الليمفاوية في المكان 78.3 19
انتشر إلى أماكن بعيدة 62.7 47
غير معروف 68.6 8
علم الأوبئة

الوفيات من الأورام اللمفاوية والورم النخاعي المتعدد (المايلوما المتعددة) لكل 1000,000 شخص في عام 2012.
0-13
14-18
19-22
23-28
29-34
35-42
43-57
58-88
89-121
122-184
اللمفوما هي النوع الأكثر شيوعاً بين الأورام الدموية الخبيثة أو سرطان الدم في العالم المتقدّم. الورم اللمفي يشكّل 5.3% من جميع أنواع السرطان في الولايات المتحدة و55.6% من جميع أنواع سرطان الدم.
وفقا للمعهد القومي الأمريكي للصحة، تشكل الأورام اللمفاوية 5٪، وسرطان الغدد الليمفاوية هودجكين أقل من 1٪ من جميع حالات السرطان في الولايات المتحدة.
ولأن الجهاز الليمفاوي هو جزء من نظام المناعة في الجسم، فإن المرضى الذين يعانون من ضعف في الجهاز المناعي مثل عدوى فيروس نقص المناعة البشرية أو بعض الأدوية التي تثبط المناعة لذا فعدد حالات سرطان الغدد الليمفاوية في ازدياد.
التاريخ

توماس هودجكن
نشر توماس هودجكين أول وصف لسرطان الغدد الليمفاوية في عام 1832، وسُمّي المرض باسمه.
ومنذ ذلك الحين، وُصفت العديد من الأشكال الأخرى من سرطان الغدد الليمفاوية.
الأبحاثتركز الأبحاث على أفضل السُّبُل والوسائل الفعّآلة للعلاج، وتحسين حياة المرضى، أو الرعاية المناسبة بعد العلاج.وتقوم الدراسات الأساسية حول عملية المرض وكيفية تغيُّر الحمض النووي داخل خلايا سرطان الغدد الليمفاوية كلّما تقدم المرض. أما النتائج من الدراسات البحثية الأساسية فعادةً ما تكون أقل فائدة مباشرة للمرضى الذين يعانون من هذا المرض،
ولكن تساعد في تحسين فهم العلماء لسرطان الغدد الليمفاوية، وتشكل الأساس في المستقبل لعلاجات أكثر فعالية.
انظر أيضًا
لمفوما درقية
لمفوما عدوانية
لمفوما جلدية
لمفوما محجرية
لمفوما جريبية
لمفوما لينيرت
لمفوما تائية الخلايا
لمفوما بائية الخلايا
سرطان الدم
لمفوما هودجكين
لمفوما لاهودجكينية
لمفوما الخلايا القاتلة الطبيعية الأرومية
لمفوما بائية الخلايا للمنطقة الهامشية العقدية
=======
سرطان الغدد الليمفاوية أو ورم الغدد اللمفاوية أو اللمفوما أو اللِمفُومة (بالإنجليزية: Lymphoma) هو مجموعة أورام خلايا الدم التي تنشأ من (الخلايا اللمفاوية) الموجودة في الجهاز اللمفاوي حيث تشكل هذه الخلايا ما يعرف بالشبكة البطانية، وكثيرًا ما يشير هذا الاسم إلى الأنواع السرطانية من هذه الأورام. وتشمل العلامات والأعراض المُصاحبة لهذا المرض، تضخم العقد الليمفاوية، والحمى، والتعرق الغزير خاصة بالليل، بالإضافة إلى فقدان الوزن، والحكة، والشعور بالتعب. وعادة ما تكون الغدد الليمفاوية المتضخمة غير مؤلمة.هناك العشرات من الأنواع الفرعية من الأورام اللمفاوية، ولكن النوعين الرئيسيين هما لمفومة هودجكين واللمفومة اللاهودجكينية والتي تُعد أكثر خطورة من لمفومة هودجكين. تضم منظمة الصحة العالمية فئتين غيرهما من أنواع سرطان الغدد الليمفاوية: الورم النخاعي المتعدد والأمراض المناعية التكاثرية. وحوالي 90٪ من الأورام اللمفاوية من نوع اللمفومة اللاهودجكينية، ويُعتبر سرطان الغدد الليمفاوية وابيضاض الدم جزء من مجموعة أوسع من أورام الأنسجة المكونة للدم والنسيج الليمفاوي.هُناك عدة عوامل خطرة للمفومة هودجكين، وتشمل: العدوى بفيروس إبشتاين بار وتاريخ مرضي للأسرة من قبل. أما عوامل الخطر للمفومة اللاهودجكينية فتشمل: أمراض المناعة الذاتية، وفيروس نقص المناعة البشرية/الإيدز، والأدوية المثبطة للمناعة، وبعض المبيدات الحشرية، وقد يؤدي تناول كميات كبيرة من اللحوم الحمراء إلى زيادة خطر الإصابة بالمرض.وعادةً ما يكون التشخيص في حالة تضخم العقد اللمفاوية عن طريق أخذ خزعة من العقدة الليمفاوية المتضخمة، وأيضًا عن طريق اختبارات الدم والبول وفحص نخاع العظم، وقد تكون مفيدة في التشخيص. وغالبًا ما ينتشر سرطان الغدد الليمفاوية إلى الرئتين، وَالكبد، و/أو الدماغ. وقد يشمل العلاج واحدا أو أكثر من الإجراءات التالية: العلاج الكيميائي، العلاج الإشعاعي، والعلاج الموجه والجراحة، وفي بعض الأورام اللمفاوية اللاهودجكينية، فإن زيادة كمية البروتين التي تنتجها خلايا الليمفوما تتسبب في جعل الدم سميكًا فيتم فصل البلازما لإزالة البروتين، وتعتمد النتائج على نوع السرطان الليمفاوي وقابليته للشفاء. أما بالنسبة لمعدل البقاء على قيد الحياة فيصل إلى خمس سنوات في الولايات المتحدة ولجميع أنواع سرطان الغدد الليمفاوية هو 85٪، في حين أن المعدل للورم اللاهودجكيني هو 69٪. في عام 2012؛ أُصيب بالليمفوما 566,000 وتسببت في 305,000 حالة وفاة. تشكّل الليمفوما 3-4٪ من جميع حالات السرطان، مما يجعلها المجموعة السابعة الأكثر شيوعًا. بينما في الأطفال، هي السرطان الثالث الأكثر شيوعاً. وفي كثير من الأحيان؛ تحدث في الدول المتقدمة أكثر من دول العالم النامي.
أنواع اللمفومالمفوما هودجيكنية نسبتها 15% من مجموع اللمفومات، وأنواعها: هودجكين تصلب عقدي (الأكثر انتشارًا في البالغين).
هودجكين مختلط الخلايا (الأكثر انتشارًا عند الأطفال).
هودجكين غنية بالخلايا اللمفاوية (أفضل الأنواع).
هودجكين فقيرة الخلايا اللمفاوية (الأسوأ والأخطر). لمفوما لاهودجكينية نسبتها 85% من مجموع اللمفومات، وتنقسم إلى: لاهودجكنية في الخلايا اللمفية البائية B، نسبتها 85%
لاهودجكنية في الخلايا اللمفية التائية T، نسبتها 15%
أسباب اللمفوما وعوامل الخطورة
العمر - معظم الأورام اللمفاوية تصيب الأشخاص أكثر من 60 سنة.
العِرق - في الولايات المتحدة، الأمريكيون من أصل أفريقي والأميركيون الآسيويون يكونون أقل عرضة من الأميركيين البيض، كما أن المرض أكثر شيوعًا في دول العالم المتقدم.
المواد الكيميائية والإشعاعية - تم ربط بعض المواد الكيميائية المستخدمة في الزراعة مثل المبيدات الحشرية والبنزين، وكذلك التعرض للإشعاع النووي بالإصابة بالمرض، وأيضًا بعض صبغات الشعر خاصةً المُستخدَمة قبل عام 1980.
نقص المناعة - على سبيل المثال، الإصابة بفيروس نقص المناعة البشرية أو في زرع الأعضاء.
أمراض المناعة الذاتية، والتي يهاجم فيها الجهاز المناعي خلايا الجسم نفسه.
العدوى - بعض الالتهابات الفيروسية والبكتيرية تزيد من مخاطر الإصابة. مثل العدوى ببكتيريا هيليكوباكتر، أو فيروس إبشتاين بار (الفيروس الذي يسبب الحمى الغدية) والتهاب الكبد الفيروسي.
الوراثة - وجود تاريخ عائلي لسرطان الغدد الليمفاوية.
الأعراض والعلامات

الغدد الليمفاوية الأكثر عرضة للإصابة بالسرطان
قد يظهر سرطان الغدد الليمفاوية مع بعض الأعراض غير المحددة. فإذا كانت الأعراض مستمرة، يجب الفحص والتقييم لتحديد الأسباب، ومن بينها سرطان الغدد الليمفاوية. تورم الغدد الليمفاوية، هو العرض الرئيسي في سرطان الغدد الليمفاوية.أعراض من الصنف ب (الأعراض الجهازية)، يمكن أن تترافق مع كل من الليمفوما الهودجكينية واللاهودجكينية، وهي: حمى مجهولة السببتعرق ليليفقدان الوزن
وأعراض أخرى: فقدان الشهيةالتعب والإعياءضيق التنفس الحكة
التشخيص
الجهاز الليمفاوي وسرطان الغدد الليمفاوية
يتم التشخيص النهائي لسرطان الغدد الليمفاوية عن طريق أخذ خزعة من العقدة الليمفاوية، وهذا يعني الاستئصال الجزئي أو الكلي للعقدة الليمفاوية التي فُحِصَت تحت المجهر.
هذا الفحص يكشف المظاهر التشريحية المرضية التي قد تشير إلى سرطان الغدد الليمفاوية. وبعد تشخيص سرطان الغدد الليمفاوية، يمكن تنفيذ مجموعة مختلفة من الاختبارات لتحديد الأنواع المختلفة من سرطان الغدد الليمفاوية. مثل: الاختبار المناعي وقياس التدفق الخلوي والتهجين الموضعي المتألق.
التصنيف
ليمفوما هودجكين موضحة باستخدام صبغة الهيماتوكسيلين والإيوسين
الليمفوما بالمعنى الضيق هي الأورام الخبيثة من الخلايا الليمفاوية، وهو نوع من خلايا الدم البيضاء التي تنتمي إلى كل من الليمف والدم.
لذا، الليمفوما واللوكيميا هي أورام الخلايا المكوّنة للدم والأنسجة الليمفاوية. يؤثر التصنيف على العلاج وعلى تقدم المرض، وقد وُجدت عدة أنظمة لتصنيف سرطان الغدد الليمفاوية، والتي تستخدم النتائج التشريحية لتقسيم سرطان الغدد الليمفاوية إلى فئات مختلفة. عادة ما يتم التصنيف وفقًا لما يلي: ما إذا كان سرطان الغدد الليمفاوية من النوع هودجكين أم لا.
نشأ السرطان في الخلايا الليمفاوية من النوع B أو T.
موقع الخلايا السرطانية بالجسم.
ليمفوما هودجكين
المقالة الرئيسة: لمفوما هودجكين
سرطان الغدد الليمفاوية النوع هودجكين هو واحد من أكثر الأنواع المعروفة لسرطان الغدد الليمفاوية، ويختلف عن غيره من أشكال سرطان الغدد الليمفاوية في تقدم المرض والعديد من الخصائص المرضية. ويتميز هذا النوع بوجود نوع من الخلايا تسمى خلايا ريد-ستيرنبرغ.
الأورام الليمفاوية لاهودجكين
المقالة الرئيسة: لمفوما لاهودجكينية
الأورام اللمفاوية لاهودجكين، والتي تعرف بأنها كل الأورام اللمفاوية عدا ليمفوما هودجكين، وهي أكثر شيوعًا من النوع هودجكين. تضم هذه الفئة مجموعة واسعة من الأورام اللمفاوية، تختلف أسباب وأنواع الخلايا المصابة، وتقدم المرض باختلاف النوع. وتزيد احتمالات الإصابة بسرطان الغدد الليمفاوية لاهودجكين مع التقدم في السن. وتنقسم كذلك إلى عدة أنواع فرعية.
تصنيف منظمة الصحة العالميةيستند تصنيف منظمة الصحة العالمية، والذي نُشر عام 2001 وجرى تحديثه في عام 2008،
على الأسس التي وُضعت ضمن «التصنيف الأوروبي الأمريكي لسرطان الغدد الليمفاوية» (REAL). يصنّف هذا النظام الليمفوما حسب نوع الخلايا والمظهر المحدّد، أو الخصائص الوراثية الخلوية.
بعض أنواع سرطان الغدد الليمفاوية بطيئة؛ أي أنها متوافقة مع حياة طويلة حتى بدون علاج، في حين أن هناك أشكال أخرى عدوانية (مثل لمفوما بيركيت)، تتسبب في التدهور السريع والموت. لكن بشكل عام معظم الأورام اللمفاوية حتى العدوانية تستجيب جيدًا للعلاج وقابلة للشفاء. يعتمد تقدم المرض على التشخيص وتصنيف المرض الصحيحين.
تصنيفات قديمة

سرطان الغدد الليمفاوية، لاحظ المعالم غير المنتظمة للنواة كما تُظهر الخلايا CD5 ،CD20 والسيكلين D1 بصبغة الهيماتوكسيلين والإيوسين
اُستخدمت العديد من التصنيفات السابقة، بما في ذلك رابابورت 1956، كييل 1974، وREAL 1994. وكانت تلك التصنيفات تستبعد لمفوما هودجكين وتقسم الأورام اللمفاوية المتبقية إلى أربع درجات (منخفضة، متوسطة، عالية، والمتنوعة) اعتمادًا على تقدم المرض، مع بعض التقسيمات الفرعية على أساس حجم وشكل الخلايا المصابة. ولكن لم تشمل هذه التصنيفات أي معلومات حول علامات سطح الخلية، أو علم الوراثة، ولم تضع أي تمييز بين الأورام اللمفاوية في الخلايا T والأورام اللمفاوية في الخلايا B. كانت من قبل مقبولة على نطاق واسع، أما الآن فلم تعد تُستخدم. إلا من قِبل بعض وكالات السرطان لجمع الإحصاءات عن سرطان الغدد الليمفاوية والمقارنات التاريخية.
مراحل المرض
بعد التشخيص وقبل العلاج، يجب معرفة مرحلة المرض والتي تحدد ما إذا كان السرطان لازال في مكانٍ محدد أم انتشر إلى أماكن بعيدة.
يُسْتَخْدَم نظام التصنيف آن أربور بشكل روتيني لتنظيم كل من الليمفوما الهودجكينية واللاهودجكينية. في هذا النظام المتدرج، تمثل المرحلة الأولى أن المرض محدد في واحدة من العقد الليمفاوية، والثانية تمثل وجود سرطان الغدد الليمفاوية في اثنين أو أكثر من الغدد الليمفاوية، والثالثة تمثل انتشار سرطان الغدد الليمفاوية على جانبي الحجاب الحاجز، والرابعة تشير إلى انتشار المرض للأنسجة الأخرى غير العقد الليمفاوية.
تُستخدم الأشعة المقطعية أو التصوير بالمسح الضوئي PET لتحديد مرحلة السرطان.
العلاجيختلف العلاج باختلاف أنواع سرطان الغدد الليمفاوية،
ويعتمد أيضًا على درجة الورم، إشارةً إلى سرعة تكاثره، وعلى عكس المتوقع؛ الليمفوما الأعلى درجة تُعَالَج بسهولة أكبر ويكون تقدم المرض أفضل: مثل ليمفوما بيركيت وهو ورم عالي الدرجة معروف أنه يتضاعف في غضون أيام، رغم ذلك استجابته جيدة للغاية للعلاج. الأورام اللمفاوية تكون قابلة للشفاء إذا اُكْتُشِفَت في مراحل مبكرة مع توافر طرق العلاج الحديثة.
الليمفوما منخفضة الدرجة
سرطان الغدد الليمفاوية هودجكين، النوع الذي تسود فيه الخلايا الليمفاوية العقدية. لاحظ تكوين العقد الليمفاوية ومناطق التبقيع (صبغة الهيماتوكسيلين والإيوسين)
تظل العديد من الأورام اللمفاوية منخفضة الدرجة بطيئة لسنوات عديدة. وغالبًا ما نتجنب العلاج للمريض الذي لا تظهر عليه أعراض، نكتفي فقط بالانتظار والمتابعة. وذلك لأن الأضرار والمخاطر الناتجة عن العلاج تفوق الفوائد. أما عند ظهور الأعراض فيكون العلاج الإشعاعي أو العلاج الكيميائي هما الاختيار؛ على الرغم من أنها ليست علاجا نهائيا لسرطان الغدد الليمفاوية، وإنما يمكن أن تخفف الأعراض، لا سيما تضخم العقد اللمفاوية. المرضى الذين يعانون من هذه الأنواع من سرطان الغدد الليمفاوية يمكن أن يعيشوا أعمارًا شبه طبيعية، ولكن بدون شفاء من المرض. هناك دعوات لاستخدام ريتوكسيماب في علاج سرطان الغدد الليمفاوية بدلا من الانتظار والمتابعة تجنبًا للقلق الشديد لدى المرضى.
الليمفوما عالية الدرجة

توضيح للأماكن الأكثر عرضة لانتشار سرطان الغدد الليمفاوية: المخ والكبد والعظام.
يمكن أيضًا علاج بعض الأنواع الأخرى الأكثر شراسة في معظم الحالات، ولكن تدهور الحالة للمرضى ضعيفي الاستجابة للعلاج يكون سريعًا وسيئًا جدا، لذا يكون العلاج عادةً علاج كيميائي أقوى، بما في ذلك CHOP أو R-CHOP. تحدث معظم حالات الانتكاس في العامين الأولين، ثم يقل خطر الانتكاس بشكل ملحوظ بعد ذلك. وفي هذه الحالة يكون العلاج الكيميائي بجرعة عالية يليه زرع ذاتي للخلايا الجذعية.
علاج ليمفوما هودجكين

سرطان الغدد الليمفاوية، النوع الذي تسود فيه الخلايا الليمفاوية: لاحظ وجود خلايا L & H، التي تعرف أيضا باسم "خلايا الفشار". (صبغة الهيماتوكسيلين والإيوسين)
عادة ما يتم علاج ليمفوما هودجكين بالعلاج الإشعاعي وحده، طالما لم ينتشر السرطان.بينما مرض هودجكين المتقدم يتطلب نظامًا من العلاج الكيميائي، مترافقًا مع العلاج الإشعاعي في بعض الأحيان. ويشمل العلاج الكيميائي المستخدم: نظام أيه بي في دي (علاج)، والذي يُستخدم عادة في الولايات المتحدة. ومن النظم الأخرى المستخدمة في علاج ليمفوما هودجكين BEACOPP وكلاهما نُظُم فعّآلة، ولكن BEACOPP يكون أكثر سُميّة إلى جانب استعمال السنانفورد V. لايزال من الممكن إنقاذ عدد كبير من الناس الذين ينتكسون بعد نظام ABVD عن طريق زرع الخلايا الجذعية.
الرعاية المسكّنةالرعاية المسكّنة، هي رعاية طبية متخصصة تركز على الأعراض، والآلام، والقلق الناتج عن الإصابة بمرض خطير، فهي مفيدة لمعالجة كل من الأعراض المباشرة لسرطان الغدد الليمفاوية والعديد من الآثار الجانبية التي تنشأ من العلاج. تكون مفيدة بشكل خاص للأطفال، حيث تساعد كل من الأطفال وعائلاتهم على التعامل مع الأعراض الجسدية والنفسية لهذا المرض. وأيضًا لها أهمية خاصة للمرضى الذين يحتاجون زرع نخاع العظام.
تقدُّم المرض
معدل البقاء على قيد الحياة لمدة خمس سنوات وِفقًا للمرحلة التشخيصية
المرحلة التشخيصية معدل البقاء على قيد الحياة لمدة خمس سنوات (%) النسبة المئوية للحالات (%)
محدد في الموقع الأوّلي للسرطان 82.3 26
انتشر إلى العقد الليمفاوية في المكان 78.3 19
انتشر إلى أماكن بعيدة 62.7 47
غير معروف 68.6 8
علم الأوبئة

الوفيات من الأورام اللمفاوية والورم النخاعي المتعدد (المايلوما المتعددة) لكل 1000,000 شخص في عام 2012.
0-13
14-18
19-22
23-28
29-34
35-42
43-57
58-88
89-121
122-184
اللمفوما هي النوع الأكثر شيوعاً بين الأورام الدموية الخبيثة أو سرطان الدم في العالم المتقدّم. الورم اللمفي يشكّل 5.3% من جميع أنواع السرطان في الولايات المتحدة و55.6% من جميع أنواع سرطان الدم.
وفقا للمعهد القومي الأمريكي للصحة، تشكل الأورام اللمفاوية 5٪، وسرطان الغدد الليمفاوية هودجكين أقل من 1٪ من جميع حالات السرطان في الولايات المتحدة.
ولأن الجهاز الليمفاوي هو جزء من نظام المناعة في الجسم، فإن المرضى الذين يعانون من ضعف في الجهاز المناعي مثل عدوى فيروس نقص المناعة البشرية أو بعض الأدوية التي تثبط المناعة لذا فعدد حالات سرطان الغدد الليمفاوية في ازدياد.
التاريخ

توماس هودجكن
نشر توماس هودجكين أول وصف لسرطان الغدد الليمفاوية في عام 1832، وسُمّي المرض باسمه.
ومنذ ذلك الحين، وُصفت العديد من الأشكال الأخرى من سرطان الغدد الليمفاوية.
الأبحاثتركز الأبحاث على أفضل السُّبُل والوسائل الفعّآلة للعلاج، وتحسين حياة المرضى، أو الرعاية المناسبة بعد العلاج.وتقوم الدراسات الأساسية حول عملية المرض وكيفية تغيُّر الحمض النووي داخل خلايا سرطان الغدد الليمفاوية كلّما تقدم المرض. أما النتائج من الدراسات البحثية الأساسية فعادةً ما تكون أقل فائدة مباشرة للمرضى الذين يعانون من هذا المرض،
ولكن تساعد في تحسين فهم العلماء لسرطان الغدد الليمفاوية، وتشكل الأساس في المستقبل لعلاجات أكثر فعالية.
انظر أيضًا
لمفوما درقية
لمفوما عدوانية
لمفوما جلدية
لمفوما محجرية
لمفوما جريبية
لمفوما لينيرت
لمفوما تائية الخلايا
لمفوما بائية الخلايا
سرطان الدم
لمفوما هودجكين
لمفوما لاهودجكينية
لمفوما الخلايا القاتلة الطبيعية الأرومية
لمفوما بائية الخلايا للمنطقة الهامشية العقدية
=======

ليست هناك تعليقات:
إرسال تعليق